截至2016年7月底,国家食药监总局公布了36家企业的飞行检查结果。随着飞行检查力度的加大,越来越多的企业开始对其重视,飞行检查已成为器械行业关注的热点话题。
为增强企业的防范意识,8月25日下午,江苏医疗器械科技产业园联合苏州致众医疗技术服务有限公司在苏州园区举办了一场医疗器械飞行检查专题培训会。来自园区及其周边区域的30多家企业参加了此次培训会,现场人数约50人。致众质量总监卫根学为大家做培训分享。

主讲人以《关于印发医疗器械生产企业飞行检查工作程序(试行)的通知》为起点,介绍了飞行检查的背景、定义、目的、范围、程序等内容。对新法规的特点,主讲人做了重点讲解。对比原法规,新法规一是内容更丰富,首次将流通和使用环节纳入到飞行检查范围;二是建立了风险研判和分层处理措施,解决了风险有效管控的问题;三是依法独立,强调全方位多层次的衔接配合,建立了顺畅的协调机制;四是可操作性更强:丰富和细化了应对手段,提升了飞行检查的可操作性和权威性;五是参考了FDA的《机构拖延、否认、限制、拒绝药品检查的指南》;六是落实监管部门职责,强化执法监督。

主讲人在培训中重点提到了“4个数字”:7种情形启动飞检、6种监管人员行为、5种情形从重处罚、4种情形治安处罚。(详见图解)
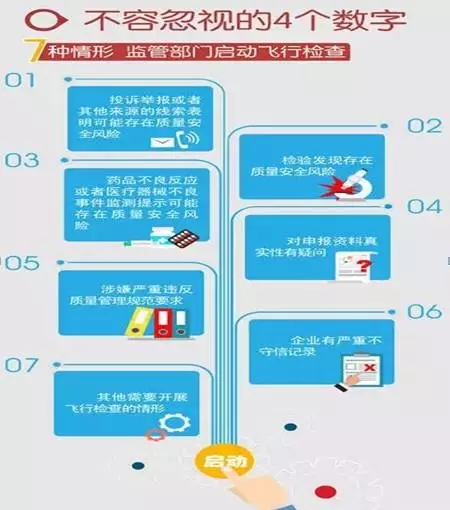
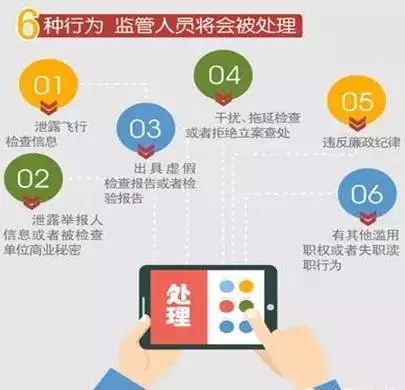


飞行检查在CE、FDA法规体系中也存在,主讲人对这三种飞行检查进行了对比,指出了其异同之处。(详见图解)
|
国家地区 |
国内 CFDA |
欧盟 CE |
美国FDA |
|
核查特点 |
有因核查 |
正常 监督核查 |
特殊核查 (有因) |
|
覆盖环节 |
研发、生产、经营、使用 |
研发、生产、核心供应商、分包商 |
注册企业 |
|
费用承担方 |
CFDA |
企业 |
FDA |
|
策略 |
迎审机制、预案 |
迎审机制 |
内部风险评估 |
在培训中,主讲人与企业代表们频繁互动,实时解答他们的疑问。整个培训会持续了三个半小时,与会者感觉收获满满,某企业代表在微信朋友圈中发表培训感言:“飞检是有因检查(已抓着辫子了),此因主要有七:举报,产品抽检发现风险,不良事件触发,申报资料存疑,涉嫌违反质量规范,企业有较大失信记录,其他规定适用飞检情形。检查办法14号令,依据是法规要求如64号令。企业应对,无它,唯合法经营,合规生产。谢谢致众卫总的培训分享!”


