(成果类型:工作组成果)
发布时间:2023年3月27日,最后修订时间:2023年3月27日
一、应用价值
建设《结直肠癌CT及MR图像标准数据库数据标准体系》目的是建设一套科学完善且高质量的、获得专家认可的结直肠癌CT及MR图像数字化和智能化的行业标准和规范,并遵循该标准体系建立和完善属于我国独有的结直肠癌CT及MR图像标准数据库。
建立国家层面首个权威、规范、安全的结直肠癌CT及MR图像标准数据库,以应用于验证结直肠癌CT及MR图像AI产品的性能,包括结直肠癌筛查、诊断、定量评估、质量控制等,促进医学人工智能产品研发和落地,并广泛推广和服务于医疗健康产业。
二、研究背景
下面分别介绍成果立项的背景、目的、任务、研究过程,研究重点及创新点。
(一) 背景:
结直肠癌是威胁人类健康的重大疾病。2020年世界卫生组织的统计数据表明,结直肠癌发病率位居全球第三位,死亡率全球第二位。我国结直肠癌的年龄标准化发病率及死亡率近年来呈逐年攀升态势,结直肠癌新发病率在全部恶性肿瘤中已升至今第二位,已成为严重威胁居民健康的主要癌症。针对结直肠癌高效诊疗的科学研究拥有重大的临床转化价值和社会意义,是提高我国人民健康水平的重大且迫切的需求。
电子计算机断层扫描(CT)和磁共振成像(MR)是目前结直肠癌治疗前评估以及疗效评估的主要影像学检查方法。但由于结直肠癌处于腹腔环境、影像背景复杂,致使人工判断难度较高,而且常规的人工影像评估方式主观性较强,易受成像质量和人工经验等因素影响,从而导致一定程度的诊断误判和漏判。中国既是一个人口大国,又是发展中国家,各地区的经济水平和医疗资源条件不一,这些实际情况的存在严重制约了结直肠癌CT及MR影像判断的质量。
近年来,伴随着计算机技术尤其是人工智能(Artificial Intelligence,AI)技术的飞速发展,使得计算机辅助智能阅片成为可能,它能够显著提高阅片速度,提高工作效率,有效解决结直肠癌CT及MR影像精准检出、诊断与疗效评价等临床问题。国家工信部在制定《大数据产业“十五”发展规划》中,支持大数据技术和产业创新发展,提升大产业支撑能力,培育新业态新模式。开发面向医疗等数据密集型行业的大数据应用解决方案,医疗行业将首先迈入大数据时代。
当前市场上,不仅尚未出现针对结直肠癌CT及MR影像智能阅片的成熟AI产品,也尚缺少对此类AI产品的有效评价手段。因此建立结直肠癌CT及MR图像数据标准,并依据该标准构建结直肠癌CT及MR图像标准数据库用于验证此类AI 产品的有效性,对促进结直肠癌CT及MR图像人工智能产品研发、测评、注册以及应用具有重要意义。
(二) 目的
建立可用于指导人工智能医疗器械研发的结直肠癌CT及MR图像数据标准,并构建结直肠癌CT及MR图像标准数据库。
(三) 任务安排
2022年第三季度:在数据治理工作组专家指导下,完成数据标准体系文档的编写;
2022年第四季度:完成数据标准专家评审;
2023年第一季度:完成数据标准平台评审和发布,并基于最终发布版本启动标准数据库的数据采集、标注和质控等工作;
2023年第二季度:完成标准数据库第一期建设,纳入不少于1000例数据。
(四) 研究重点
该研究的重点是在结合结直肠癌CT及MR影像业务流程的基础之上,如何确保该标准体系的权威性、科学性、规范性,同时确保标准数据库的数据多样性、完整性、一致性、可追溯性以及可用性,以及数据库的封闭性和动态性,因此每个环节都要保持记录、加强质控。
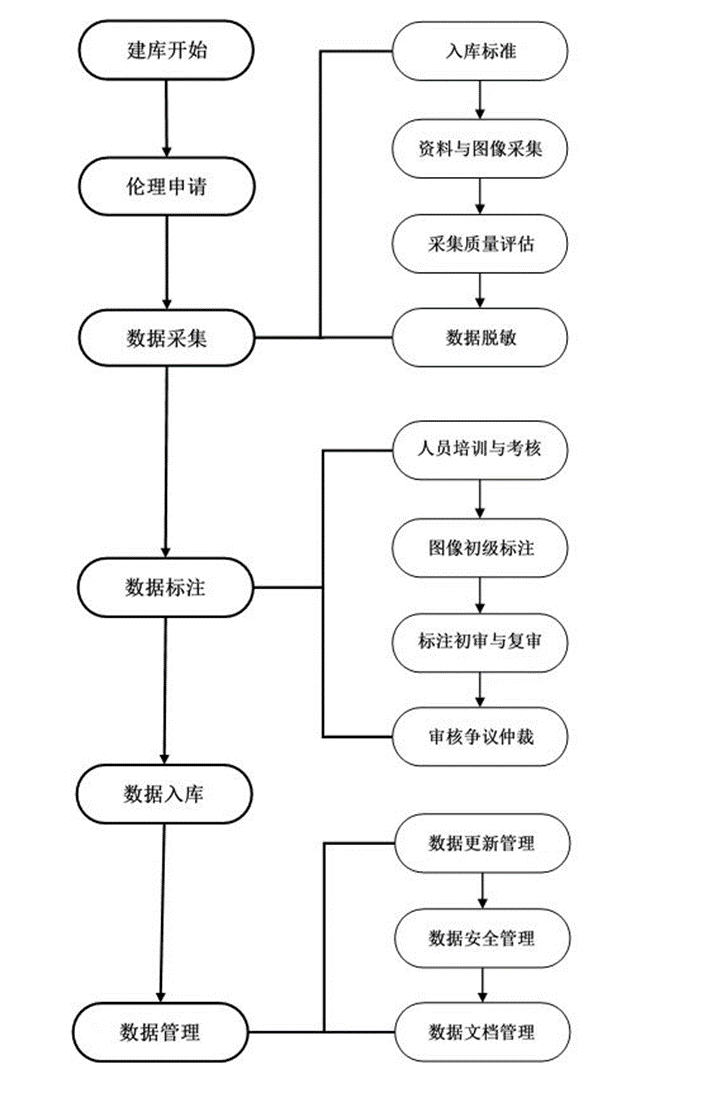
其中纳入标准包括:1)年龄≥18周岁;2)行结直肠相关MR、CT等影像检查,且行腹部检查。排除标准包括:1)呼吸运动等伪影明显以致不能满足诊断要求;2)重要临床数据缺失,如MR/CT影像检查、基础数据及实验室检查资料不完整,治疗后病理诊断结果缺失等;3)患者诊断不明确,如既无病理诊断,又非临床确诊。
(五) 创新点
该标准体系是我国首个由放射学专家带领下,由医学和计算机专业团队联合研发的一套系统的、全面的结直肠癌CT及MR图像数据标准体系,符合临床实践,同时也严格遵循国家药监局颁布的《深度学习辅助决策医疗器械软件审评要点》的要求,既可以指导相关人工智能医疗器械企业在研发过程中数据管理的实践,也可以作为行业标准用于评估相关人工智能医疗器械企业的数据管理能力。
经平台管理委员会2022年第2次管理委员会会议讨论通过立项申请、审议通过。
三、完成单位
国家药监局医疗器械技术审评中心人工智能医疗器械创新合作平台数据治理工作组、浙江求是数理医学研究院、浙江大学医学院附属邵逸夫医院、首都医科大学附属北京友谊医院、上海交通大学医学院附属新华医院、福建医科大学附属协和医院、河南省肿瘤医院、苏州大学附属第一医院、苏州大学附属第二医院、南京大学医学院附属鼓楼医院、辽宁省肿瘤医院、沈阳市第四人民医院、鞍山市中心医院、广西医科大学第一附属医院、桂林医学院附属医院、柳州市人民医院、云南省肿瘤医院、西双版纳傣族自治州人民医院、普洱市人民医院、青岛大学附属医院、青岛市中心医院、中科大附一院(安徽省立医院)、中国科学院合肥肿瘤医院、安徽省肿瘤医院、新疆医科大学第一附属医院、新疆医科大学附属肿瘤医院、新疆伊犁州友谊医院、上海市同济医院、深圳大学第一附属医院(深圳市第二人民医院)、广西医科大学附属肿瘤医院、中南大学湘雅三医院、吉林大学第二医院、中山大学附属第六医院、吉林大学中日联谊医院、合肥京东方医院、云南省保山市第二人民医院、宁夏医科大学总医院、四川省人民医院、江西省人民医院、安徽理工大学附属医院 淮南东方集团总医院、皖南医学院弋矶山医院、山西白求恩医院、皖北煤电集团总医院、嘉兴市第一医院、浙江省肿瘤医院、浙江省立同德医院、台州市第一人民医院、嘉兴市第二医院、台州市立医院、宁波市第一医院、平湖市第一人民医院、杭州市第三人民医院、浙江大学医学院附属第一医院、浙江大学医学院附属第二医院、杭州市萧山区第一人民医院、东阳市人民医院、中国科学院大学宁波华美医院、浙江省丽水市中心医院、宁波大学附属人民医院。(排名不分先后)
四、成果概况
本成果是一整套数据标准体系文档,共包括1份质量手册,以及3大过程,共包含3大标准规程,及31份记录表单模板,具体请参见附件。
五、下一步工作
在项目基础上征求意见,进一步完善,形成发布稿,根据行业专家建议的数据分布比例采集数据,统一标注和质控,建立包括不少于1000例样本的标准数据库。
联系人:孙继红
联系方式:sunjihong@zju.edu.cn
附件:下载