2016年7月6日,CFDA连续发布5家医疗器械企业飞行检查通报,其中:
限期整改3家
北京市富乐科技开发有限公司(植入器械)
湖北仙明医疗器械有限公司(无菌器械)
天新福(北京)医疗器械股份有限公司(植入器械)
停产核实2家
洪湖泰宁医疗器械有限公司(无菌器械)
舞钢市瑞峰医疗科技有限公司(其他器械)
致众(证券代码:833360)简要汇总了上述5家企业主要问题缺陷:
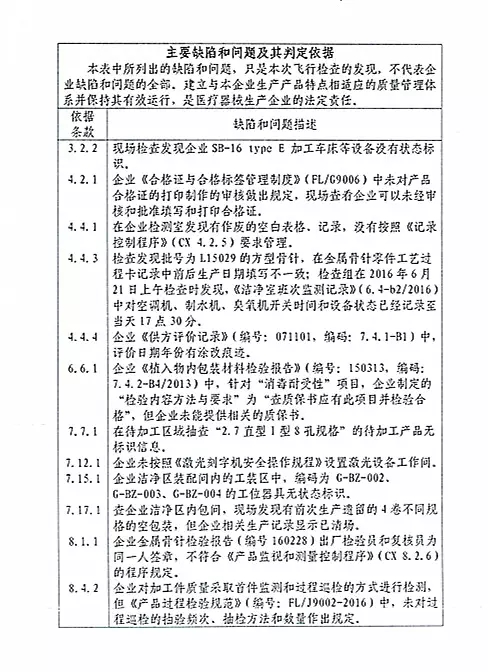
1、标识标签不符
2、缺少部分生产记录、协议和文件且部分产品的生产记录不能追溯
3、生产环节部分操作未按要求执行
相较于2016.5.23-27的飞检公告发现的主要问题【总局发布两械企停产整改通告 质控、溯源均有大问题】
1、人员:未能提供相应的培训记录或未经过培训;
2、场地设备:缺少部分生产设备且缺少部分生产记录;
3、物料采购:部分原材料未签订质量保证协议书;
4、文件管理:质量体系文件不健全;
5、质控与溯源:不合格品的处置不到位且部分产品的生产记录不能追溯。
除了记录缺陷和溯源问题是“老毛病”外,这次标识不合规成为新“主角”,作为反映医疗器械基本信息的重要载体,医疗器械说明书、标签载明了医疗器械安装、调试、操作、使用、维护和保养、安全警示等信息,直接关系到用械安全有效,不可谓事小,但从近期国家局发布的质量公告中不难看出,标识标签、说明书等项目不符合标准规定的比重越来越高。
致众(医疗器械创新创业技术法规咨询服务平台)近日刊文:【深度解读】医疗器械标签和说明书管理难题 针对说明书标识等问题做出了详细的解读和案例分享,点击熟读吧!
以下是通告原文:
| 对北京市富乐科技开发有限公司飞行检查情况 |
| 2016年07月06日 发布 |
|
北京市富乐科技开发有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,质量管理体系存在缺陷。现由北京市食品药品监督管理局责成北京市富乐科技开发有限公司对上述缺陷限期整改。
|
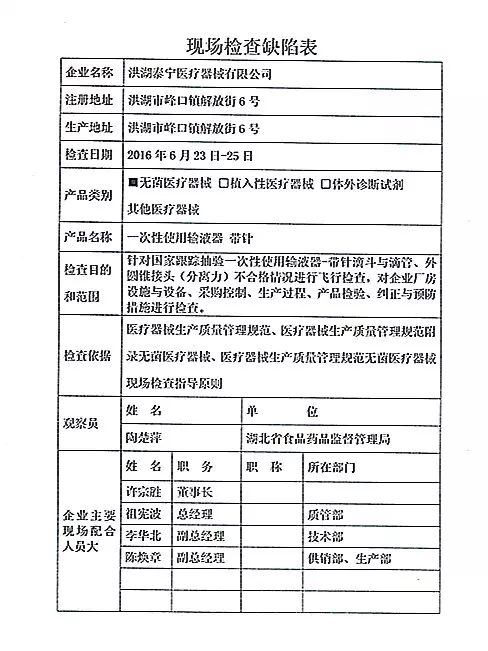
| 对洪湖泰宁医疗器械有限公司飞行检查情况 |
| 2016年07月06日 发布 |
|
洪湖泰宁医疗器械有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,质量管理体系存在缺陷。该企业于2016年6月25日申报停产。该企业恢复生产前应当按照有关规定书面报告湖北省食品药品监督管理局,经湖北省食品药品监督管理局核查符合要求后方可恢复生产。



|
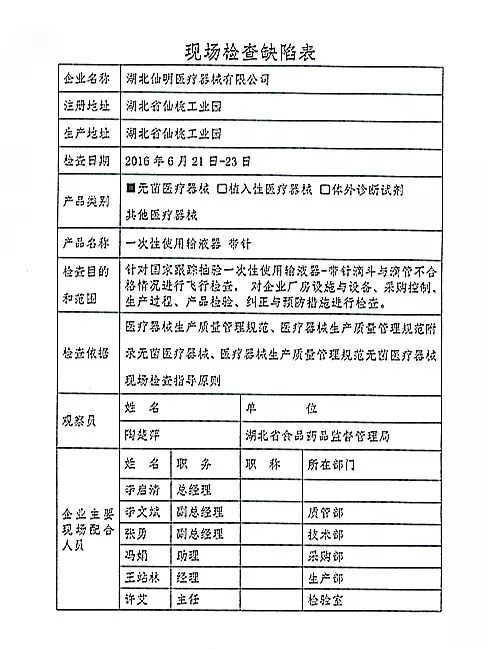
| 对湖北仙明医疗器械有限公司飞行检查情况 |
| 2016年07月06日 发布 |
|
湖北仙明医疗器械有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,质量管理体系存在缺陷。现由湖北省食品药品监督管理局责成湖北仙明医疗器械有公司对上述缺陷限期整改。


|
| 对天新福(北京)医疗器械股份有限公司飞行检查情况 |
| 2016年07月06日 发布 |
|
天新福(北京)医疗器械股份有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,质量管理体系存在缺陷。现由北京市食品药品监督管理局责成天新福(北京)医疗器械股份有限公司对上述缺陷限期整改。
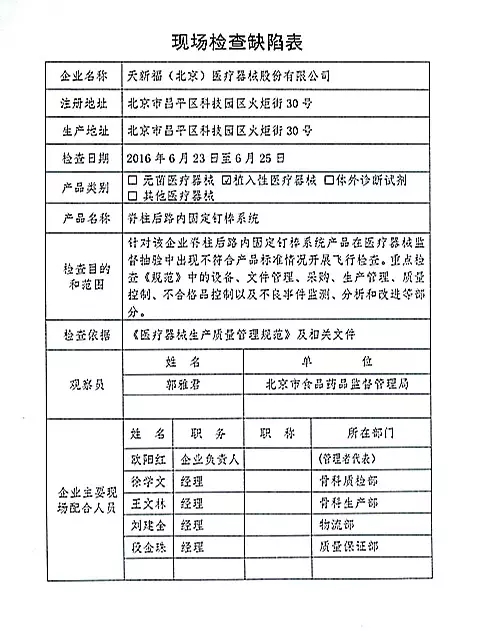
|
| 对舞钢市瑞峰医疗科技有限公司飞行检查情况 |
| 2016年07月06日 发布 |
|
舞钢市瑞峰医疗科技有限公司于2014年12月5日因各岗位人员流失严重、质量管理人员和检验人员的离岗等原因申报停产。经检查组现场核实,该企业处停产状态。该企业恢复生产前应当按照有关规定书面报告河南省食品药品监督管理局,经河南省食品药品监督管理局核查符合要求后方可恢复生产。
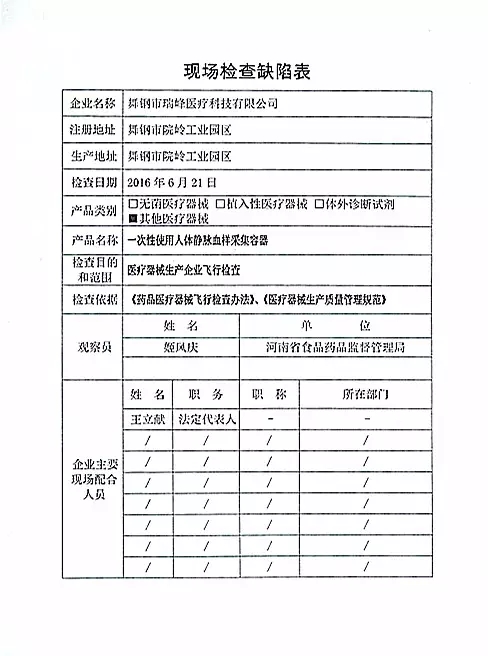

|