《医疗器械临床评价技术指导原则》于2015年05月19日发布, 指导原则中明确指出可以通过临床文献评估的途径提供医疗器械注册时的临床资料。但是通过临床文献评估的途径准备临床资料的过程中也存在很多难点,到目前为止通过临床评价资料通过国家局注册审评的案例很少,小编按照指导原则的要求编写了一个进口有源产品的临床评价资料并递交国家局,该产品已取得产品注册证。小编在此分享编写临床评价资料的经验。
1、评价路径
首先要理清临床评价资料的路径,为此我特意梳理了一个结构图,如下:
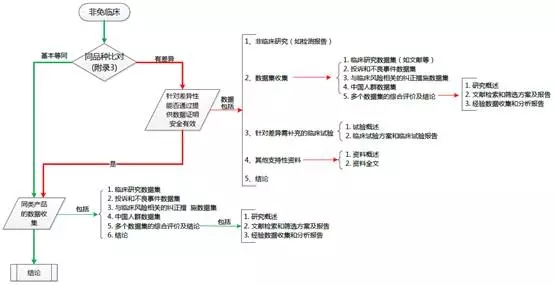
从图中看出有红色和绿色两条路径。当申报产品与对比产品基本等同时走绿色的路径,当申报产品与对比产品有差异时需先对差异性部分提供数据证明申报产品安全有效,再与同类产品进行对比。
2、数据集
数据集包括:临床研究、投诉和不良事件、与风险相关的纠正措施、中国人群数据集。怎么收集这些数据集呢?
1)临床研究数据集是收集文献、临床经验数据等;
2)投诉不良事件数据集主要是各上市国相关部门不良事件数据的公告及企业自身收集的投诉事件;
3)纠正措施数据集是针对不良事件发生后售后处理和纠正预防措施数据;
4)中国人群数据集即中国人群临床使用的数据(文献和经验数据均可)。
数据集收集完成后需对每一个数据集进行分析评价,评价主要从数据概述、分析方法、数据分析、分析结果的解释和评价四个方面进行。
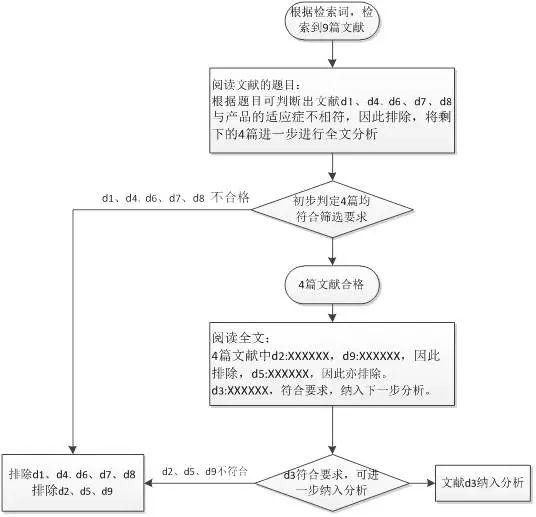
3、文献检索
文献检索和筛选也是一个很重要的部分,该部分的内容体现的是如何检索和选择文献的过程,检索时检索词很重要,一般可选产品适应症、产品型号等作为检索词;检索之后还需进行筛选,筛选流程如下:
4、同类产品资料
最后,必须提醒大家的是能通过同品种对比进行评的前提条件很多,其中一项便是“食药监械管〔2015〕247号”中明确的:依据《医疗器械临床评价技术指导原则》第六条开展临床评价的,如使用了同品种医疗器械的生产工艺、临床数据等资料,申请人应提交同品种医疗器械生产工艺、临床数据等资料的使用授权书。
临床评估资料的编写要结合产品分析、医学背景、文献检索、数据统计分析等多方面的能力,查找和引用各种数据证明产品的安全性和有效性,其难度很高,有很高的技术含量。如果通过查找文献资料、临床数据、同类产品信息等不能够证明产品的安全性和有效性,则还需要通过临床试验验证产品的安全性和有效性。
上一篇:【原创】器械伦理审查要点有哪些?
下一篇:【干货分享】监查那些事儿!