许鹏 致众副总经理
医学博士后,毕业于天津医科大学,后在美国密歇根大学进行博士后研究工作,专业方向临床医学,发表学术论文十余篇,SCI 三篇。医疗器械临床试验法规及管理专家,10余年临床行业经验,长期从事医疗器械临床评价工作,对CFDA 临床评价有深刻的了解和认识,在医疗器械产品临床试验研究方面具有丰富的知识和经验,曾经主导和参与多个大型复杂临床试验的方案设计,统计分析等工作,并作为申办方代表参加多次CFDA 组织的医疗器械项目专家评审会,主持多个临床试验项目直至获得CFDA 注册证。担任湖北省药物与医疗器械临床评价学会理事,入选第六批“光谷3551 人才计划”。
首先我们要知道,病毒是如何感染患者的。
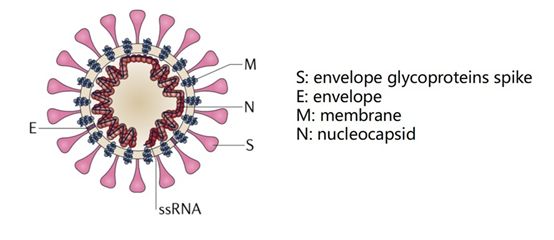
包裹病毒粒子的脂肪膜表面有三个糖蛋白:棘突糖蛋白(S, SpikeProtein,是受体结合位点、溶细胞作用和主要抗原位点);小包膜糖蛋白(E, EnvelopeProtein,较小,与胞膜结合的蛋白);膜糖蛋白(M,MembraneProtein,负责营养物质的跨膜运输、新生病毒出芽释放与病毒外包膜的形成)。少数种类还有血凝素糖蛋白(HE蛋白,Haemaglutinin-esterase)。
呼吸的机制
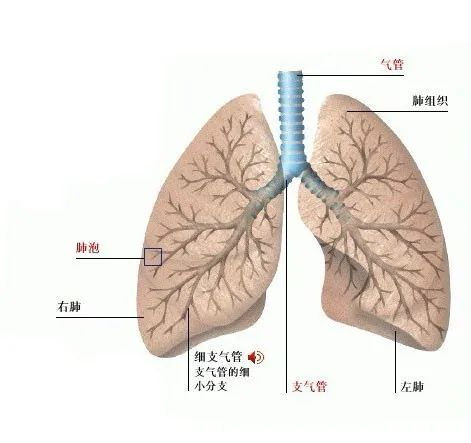
肺泡毛细血管(alveolar capillary)存在于相邻肺泡壁间,并填满肺泡之间的间隔,主要由单层的内皮细胞组成,形成管壁极薄的血管。其中约一半的内皮细胞基底膜与肺泡上皮基底膜相融合,形成肺泡毛细血管膜(ACM),具有极大的表面积和极短的扩散距离,是血气交换的重要部位。不难想象,这层膜是非常薄的,因为从这里下来的氧气必须(无阻碍地)扩散到血液中。
新冠病毒SARS-CoV-2可能的发病机制
针对中重度患者的呼吸治疗
![]()
氧气疗法(oxygen therapy)
普通氧疗的工具
鼻导管、鼻塞吸氧时FiO2一般不会超过40%,故适用于有自主呼吸、需要FiO2较低的患者。
氧疗要点
机械通气(呼吸机)时的氧疗



上一篇:复工在即,你准备好了吗?
下一篇:【原创】疫情对临床试验的影响