昨天下午,一场医疗器械飞行检查专题研讨会在汇龙森讲堂成功举行,共有20家企业,37位与会代表到场。本次活动由北京先进医疗设备产业创新联盟联合中孵高科产业孵化(北京)有限公司与致众(北京)医疗技术服务有限公司联合举办,致众质量总监卫根学为大家主题分享、互动交流。


主讲人以《关于印发医疗器械生产企业飞行检查工作程序(试行)的通知》为起点,贯穿了国内飞行检查相关的几个法规,介绍了飞行检查的背景、定义、目的、范围、程序等内容。对新法规的特点,主讲人做了重点讲解。对比原法规,新法规一是内容更丰富,首次将流通和使用环节纳入到飞行检查范围;二是建立了风险研判和分层处理措施,解决了风险有效管控的问题;三是依法独立,强调全方位多层次的衔接配合,建立了顺畅的协调机制;四是可操作性更强:丰富和细化了应对手段,提升了飞行检查的可操作性和权威性;五是参考了FDA的《机构拖延、否认、限制、拒绝药品检查的指南》;六是落实监管部门职责,强化执法监督。

主讲人在培训中重点提到了“4个数字”:7种情形启动飞行检查、6种监管人员行为、5种情形从重处罚、4种情形治安处罚。(详见图解)
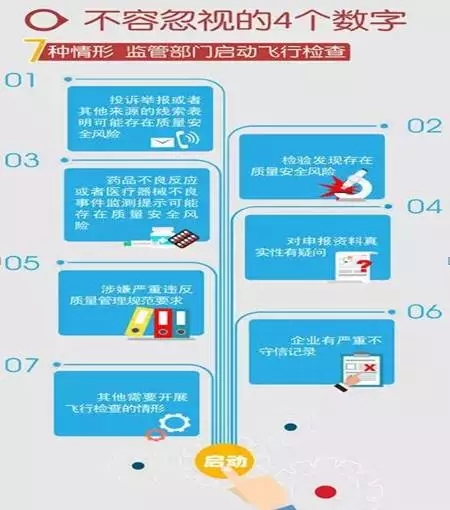
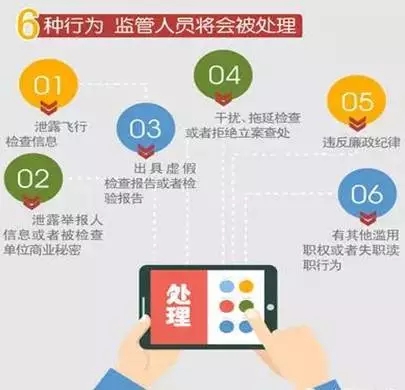


飞行检查在CE、FDA法规体系中也存在,主讲人对CFDA、CE、FDA这三种飞行检查进行了对比,指出了其异同之处。(详见图解)
|
国家地区 |
国内 CFDA |
欧盟 CE |
美国FDA |
|
核查特点 |
有因核查 |
正常 监督核查 |
特殊核查 (有因) |
|
覆盖环节 |
研发、生产、经营、使用 |
研发、生产、核心供应商、分包商 |
注册企业 |
|
费用承担方 |
CFDA |
企业 |
FDA |
|
策略 |
迎审机制、预案 |
迎审机制 |
内部风险评估 |
在持续四个小时的活动中,主讲人与参会代表们实时互动,最后主讲人针对飞行检查特点,给出了CFDA、CE、FDA的总体策略,倡导企业“持续合规”,良性发展。