【CMDE】药物洗脱外周血管支架注册技术审评报告公开
医疗器械产品注册技术审评报告
产品英文(原文)名称:Zilver PTX Drug Eluting Peripheral Stent
申请人名称:Cook Ireland Limited 库克爱尔兰有限公司
国家药品监督管理局
医疗器械技术审评中心
基本信息
一、申请人名称 Cook Ireland Limited(库克爱尔兰有限公司)
二、申请人住所 O'Halloran Road National Technology Park Limerick Ireland
三、生产地址 O'Halloran Road National Technology Park Limerick Ireland
四、代理人名称 库克(中国)医疗贸易有限公司 五、代理人住所 中国(上海)自由贸易试验区富特北路 402 号第三层中 部位
产品审评摘要
(一)产品结构及组成 该产品由预装支架和输送系统组成,含有注射器配件。支架由镍钛合金经激光雕刻工艺制成,表面涂覆紫杉醇药物 涂层,药物剂量密度 3μg/mm2,支架每个末端具有 4 个不透 射线黄金标记。产品环氧乙烷灭菌,一次性使用。
(二)产品适用范围 该产品适用于治疗参照血管直径为 4-9mm 的膝上股腘动 脉的症状性病变。为避免累及股总动脉,支架的近端应置于 股浅动脉起始部位以下至少 1cm 处;为避免累及膝下动脉, 支架的远端需置于股骨上髁水平以上位置。
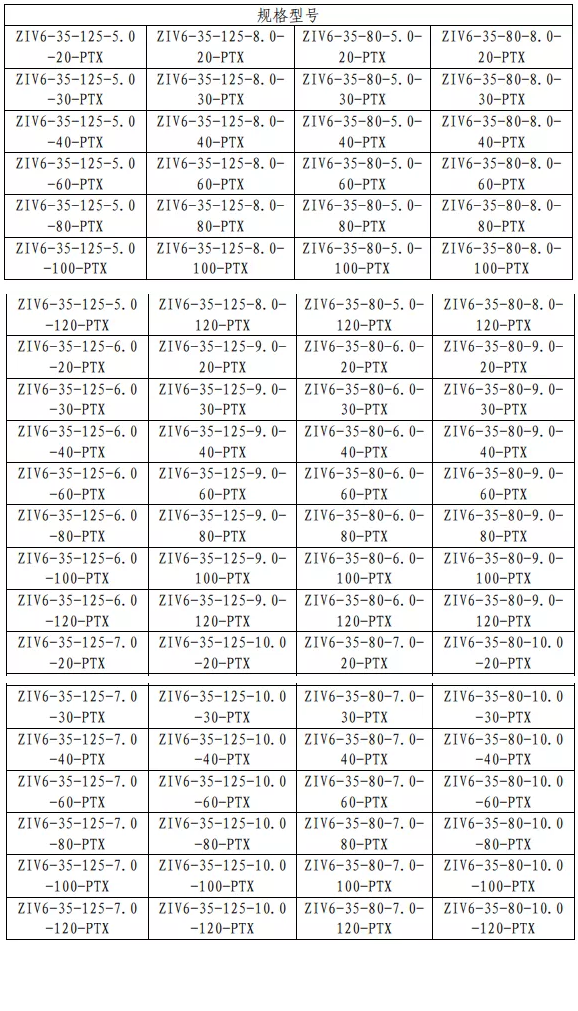
表 1 药物洗脱外周血管支架型号规格
药物洗脱外周血管支架是一种由镍钛合金制成的自膨 式支架,表面涂覆紫杉醇药物涂层。支架由激光雕刻制成, 设计用于在血管内展开后,支架对血管内腔将产生一种向外 的径向力,从而在支架植入区域保持血管通畅;紫杉醇预期 降低再狭窄发生率。
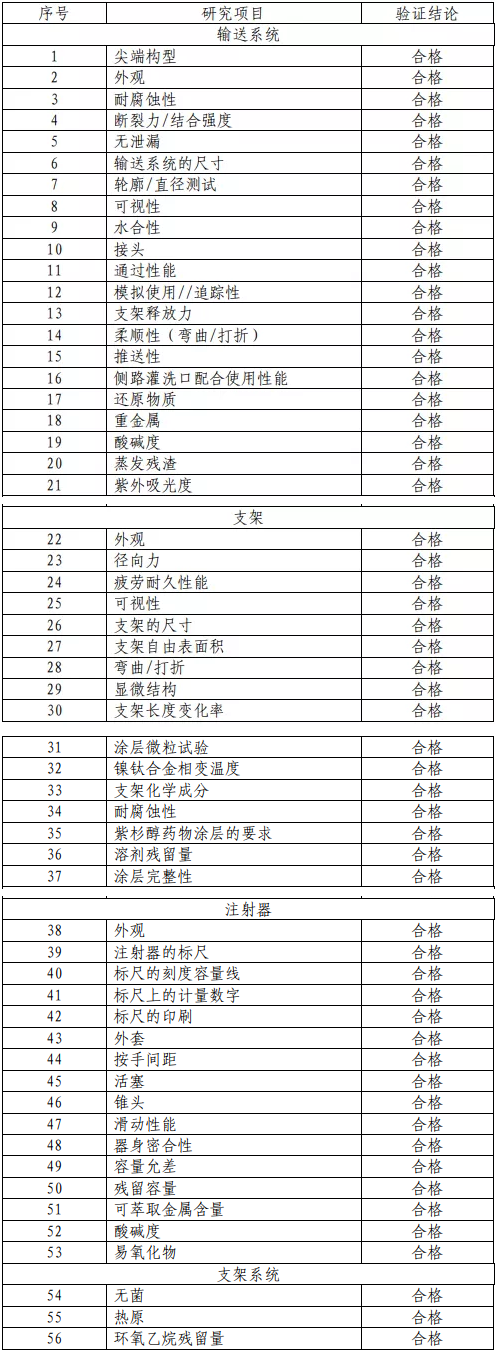
1.产品技术要求研究 技术要求研究项目如表 2 所示。
表 2 技术要求研究摘要
2.产品性能评价
产品性能评价包括支架平台轴向、弯曲、扭转和搏动疲 劳性能,重叠支架疲劳性能、涂层牢固度、有限元分析、紫 杉醇涂层鉴别和总含量、紫杉醇涂层体外释放、紫杉醇体内 外释放相关性、MRI 兼容性等研究报告。结果表明产品符合 设计输入的要求。
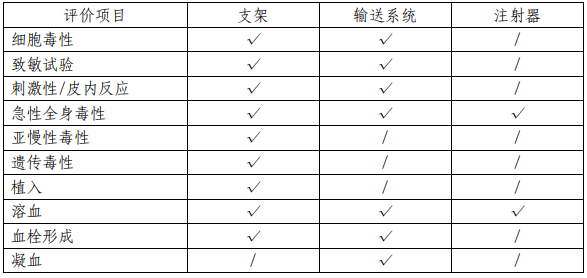
该产品由支架、输送系统和注射器组成,其中支架为植 入器械,与循环血液长期接触;输送系统为外部接入器械, 与循环血液短期接触;注射器不直接接触患者。申请人依据 GB/T16886 系列标准对支架和输送系统进行了生物相容性评 价;同时依据 GB 15810-2001 对注射器进行了生物相容性评 价。结果表明产品的生物相容性风险可接受。具体评价项目 详见表 3。
表 3 生物相容性评价项目表
该产品采用环氧乙烷灭菌,无菌状态提供。申请人提供 了灭菌确认报告,证明无菌保证水平为 10-6。
(四)产品有效期和包装 该产品货架有效期为两年。申请人提供了货架有效期验证报告,验证试验为实时老化,包括产品稳定性、包装完整 性验证等。
(五)动物研究 申请人开展了猪模型的动物试验研究以验证药物释放 情况、产品使用性能及安全性。包括 24 小时和 2 个月的药 代动力学研究;1 个月、3 个月和 6 个月的动物研究及重叠 支架动物研究;长支架和输送系统在动物体内的短期性能研 究。动物试验结果表明,产品达到预期设计要求。
申请人按照《接受医疗器械境外临床试验数据技术指导 原则》(2018 年第 13 号)提交了相关境外临床试验数据,并 补充了境内临床试验资料作为境内外人群差异对产品安全 有效性无影响的证据。
Zilver PTX 随机研究是一项前瞻性、对照、国际多中心 的研究,在全球 55 家医院共招募了 479 名患者。患者随机接受 Zilver PTX 支架 (治疗组)或 PTA (对照 组)治疗。鉴于球囊血管成形术可能无法获得急性成功,试 验设计强制性要求球囊血管成形术失败后,如急性 PTA 失败 时,需立即实施临时性支架植入。因此,次优(失败) PTA 患 者在接受 Zilver PTX 支架或 Zilver 裸支架植入前,需进行二次随机。二次随机可对 Zilver PTX 支架 vs 金属裸支架进 行评估。该临床试验的主要目的:证明 Zilver PTX 支架在膝上 股腘动脉新发或再狭窄性病灶治疗过程中,其安全性优于或 等同于经皮球囊血管成形术(PTA),而有效性则优于后者。
12个月无事件生存率,治疗组为90.4%,对照组为83.9%, 研究的安全性原假设成立。12 个月一期通畅率,治疗组为 82.7%,对照组为 32.7%,研究的有效性原假设成立。
1、研究设计 该临床试验是一项多中心、前瞻性、单臂的临床试验。在中国的 9 家临床试验机构入组了 178 名患者,并且在支架 植入后 12 个月进行了临床和影像学随访。该临床试验的主要目的:在中国患者人群中评估 Zilver PTX 支架对膝上腘动脉病变的治疗有效性。
2、研究结果 12 个月一期通畅率为 81.9%,无靶病变血运重建率为 95.5%,结果证实了 Zilver PTX 支架用于治疗中国患者股腘 动脉粥样硬化疾病的安全性和有效性。
参照《YY/T 0316-2016 医疗器械风险管理对医疗器械的应用》,对该产品进行风险分析。对目前已知及可预测风险 采取了风险控制措施,经综合评价,在目前认知水平上,认 为该产品带来的获益/受益大于风险。为保证用械安全,需 在说明书中提示以下信息:
1)对镍钛合金有过敏反应的人可能会对本产品发生过 敏反应。
2)对紫杉醇有过敏反应的人也可能会对本产品发生过 敏反应。
1) 本品供接受过血管诊断和介入技术培训并具有相关 手术经验的医师使用。在使用过程中,必须采用标准的血管 介入手术规范。
2) 操作Zilver PTX药物洗脱外周血管支架需在透视监 控下进行。
3) 如果在推进输送系统时遇到阻力,切勿强行通过。应先撤出输送系统,并换上新的器械。
5) 务必注意,在最终释放支架前,方可取下红色的安全锁。
6) 在追踪导丝,展开和移除时,应使用0.035英寸 (0.89mm)的硬导丝(如不锈钢芯Amplatz-AES超硬导丝或 Amplatz-AUS特硬导丝),确保给系统提供充分的支撑力。如 使用直径小于0.035英寸(0.89mm)的导丝,或硬度小于推荐 的导丝,可能降低系统的功能和完整性,因此不应使用。如 使用带亲水涂层的导丝,导丝在使用时应保持亲水涂层活 化。
7) 在支架释放过程中,不得试图将手柄拉离导管座方 向。
8) 不要使用过多的外力来展开支架。如果在开始释放 时感到过多的阻力,应撤出输送系统(未展开支架),同时更 换新的设备。
11) 在支架释放过程中,不得旋转系统的任何部件。12) 本器材仅限单次使用。不得重复灭菌和/或重复使 用。
13) 支架的释放操作一旦启动后,由于不能再将输送系 统鞘向前推,因此在开始释放支架后即无法再调整其植入位 置。
14) 释放支架后,如在撤出输送系统时感到阻力,应在透视导引下,小心重新推进输送系统的外鞘管,使其沿内导 管回到释放支架前的位置;不得用力过度。在此位置时撤出 系统。如果在试图撤出输送系统时仍遇到阻力,应将整个系 统连同导管鞘或导引导管整体移除。如可能,可维持导丝位 置做为随后的血管通路。将导丝留在适当位置,移除所有其 它系统部件。
4) 妊娠、哺乳或者计划在未来5年内怀孕的女性,不应 接受Zilver PTX药物洗脱外周血管支架的治疗。紫杉醇是否 会通过乳汁分泌尚属未知,因此在哺乳时,存在因紫杉醇暴 露引起婴儿不良反应的可能。
综合评价意见
本申报产品属于医疗器械优先审批项目 , 编号 20180009。申请人的注册资料符合现行要求,依据《医疗器 械监督管理条例》(国务院令 第 680 号)、《医疗器械注册管 理办法》(国家食品药品监督管理总局令 2014 年第 4 号)等相关医疗器械法规与配套规章,经系统评价后,建议准予注 册。


