中国、美国、欧盟UDI实施要求对比
01
实施时间要求:
中国、美国、欧盟对于实施UDI都采用了不同类别的产品分阶段逐步实施的方式,中国对于三类高风险的产品的要求是2020年10月1日正式实施,但对其他三类产品、二类产品和一类产品的实施时间还未提出要求,这点和美国、欧盟却别较大,美国和欧盟在发布UDI的法规时就明确了UDI分布实施的具体时间策略。
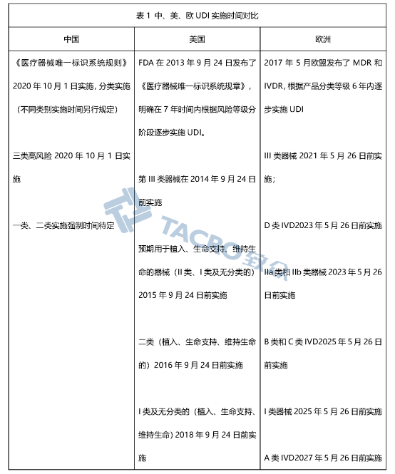
注:其中FDA和欧盟UDI实施时间是调整后的实施时间。
02
发码机构要求:
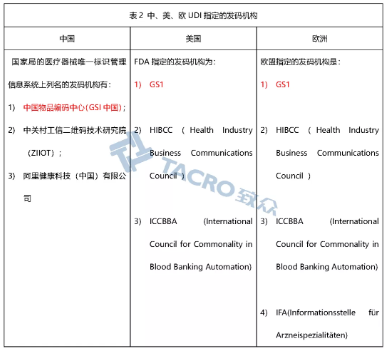
UDI的实施第一步就应确定发码机构,NMPA、FDA、欧盟对UDI的发码机构都有进行指定,所以企业在选择发码机构的时候应根据企业产品的销售市场进行确定,以确保企业的产品UDI符合上市地区的法规要求,GS1是如无特殊要求建议选择GS1。
03
UDI编码组成:
可以明确的是不管NMPA、FDA还是欧盟都要求UDI包含产品标识(DI)和生产标识(PI),不同规格型号、不同包装等级的DI应不同,PI信息企业可以自定义其需要包含的内容,建议如果企业产品的标签上有序列号/批号和有效期,这两项内容应作为PI的信息之一。

04
载体要求:
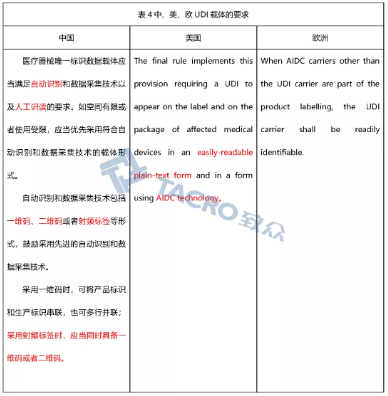
载体的要求也是大同小异,同的是都要求易读(人可识别)+自动识别(AIDC),不同的是国内的《规则》很明确的要求如采用射频标签必须同时具备一维码或二维码。
05
数据库上传要求:
中国的数据库是《医疗器械唯一标识管理信息系统》,美国的数据库是GUDID,欧盟的数据库是Eudamed(在建),目前国内的数据在试运行阶段,非试点企业也可以申请注册账号参与试运行,10月1日后将正式运行。三大数据库均只要求了必须上传产品标识即DI。

