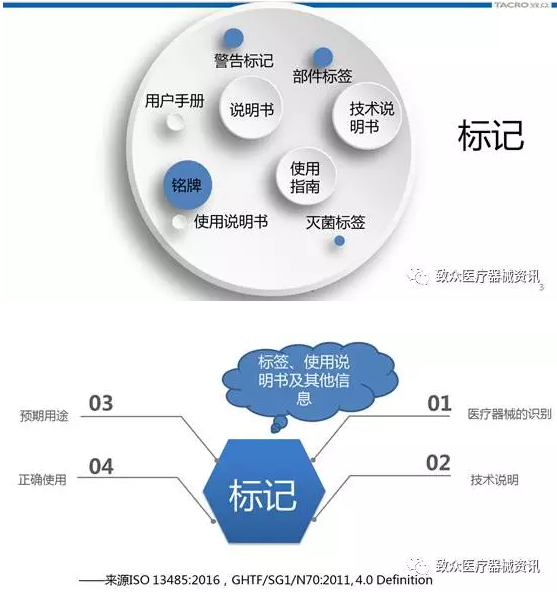
• GHTF/SG1/N70:2011其他相关定义
• Instructions for use:
– information provided by the manufacturer to inform thedevice user of the medical device’s intended purpose and proper use and of anyprecautions to be taken.
– 生产企业提供的信息,告知用户医疗器械的预期用途、正确使用和应采取的措施。
• Label
– written, printed, or graphic information eitherappearing on the medical device itself, or on the packaging of each unit, or onthe packaging of multiple devices.
– 书写、印刷或绘制于医疗器械产品本身,或每个产品包装、多个产品包装上的信息。
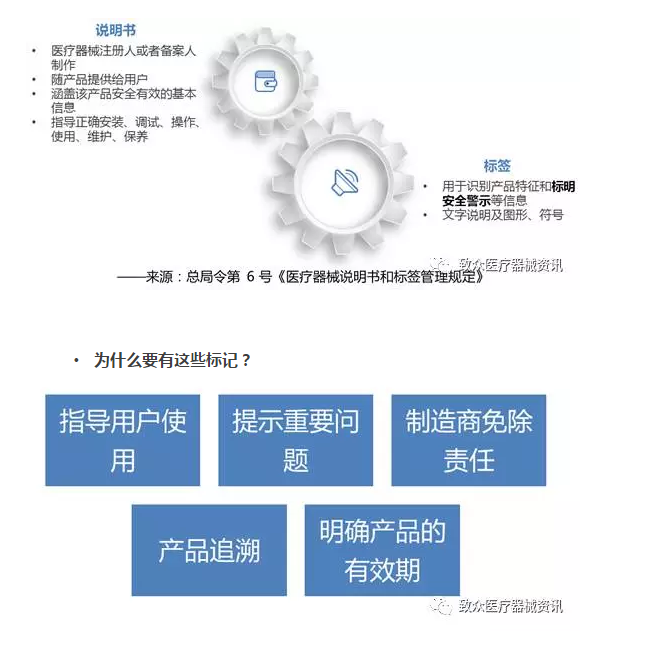
规范解读——条例
• 《医疗器械监督管理条例》里对于说明书和标签的要求
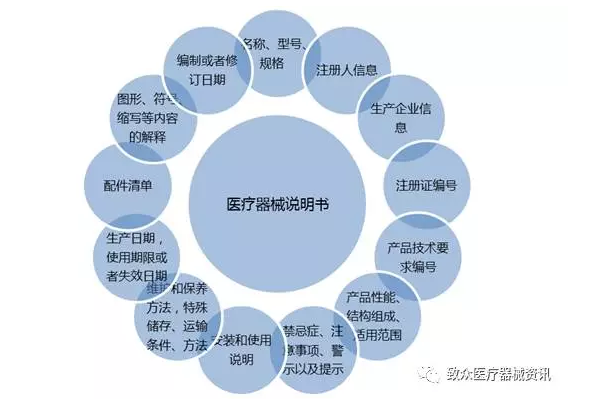
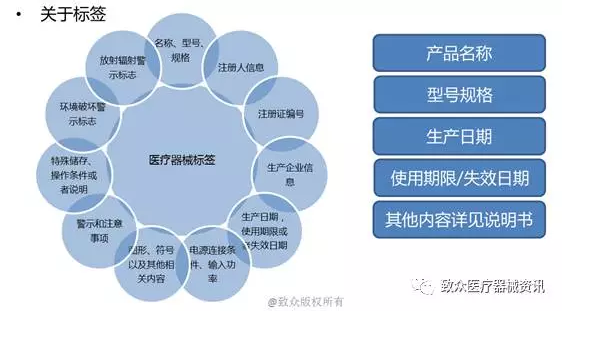
• 第二十七条 医疗器械应当有说明书、标签。说明书、标签的内容应当与经注册或者备案的相关内容一致。
医疗器械的说明书、标签应当标明下列事项:
(一)通用名称、型号、规格;
(二)生产企业的名称和住所、生产地址及联系方式;
(三)产品技术要求的编号;
(四)生产日期和使用期限或者失效日期;
(五)产品性能、主要结构、适用范围;
(六)禁忌症、注意事项以及其他需要警示或者提示的内容;
(七)安装和使用说明或者图示;
(八)维护和保养方法,特殊储存条件、方法;
(九)产品技术要求规定应当标明的其他内容。
第二类、第三类医疗器械还应当标明医疗器械注册证编号和医疗器械注册人的名称、地址及联系方式。
由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明。
规范解读——6号令
• 关于说明书
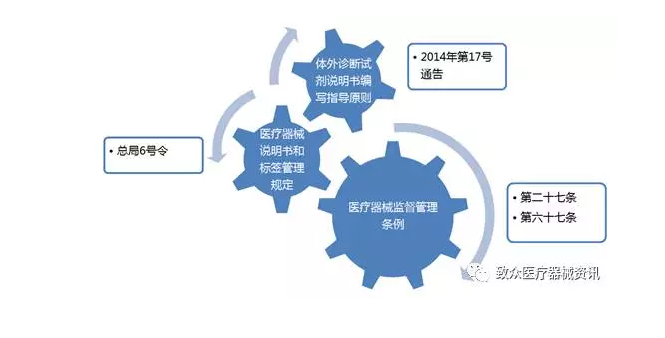
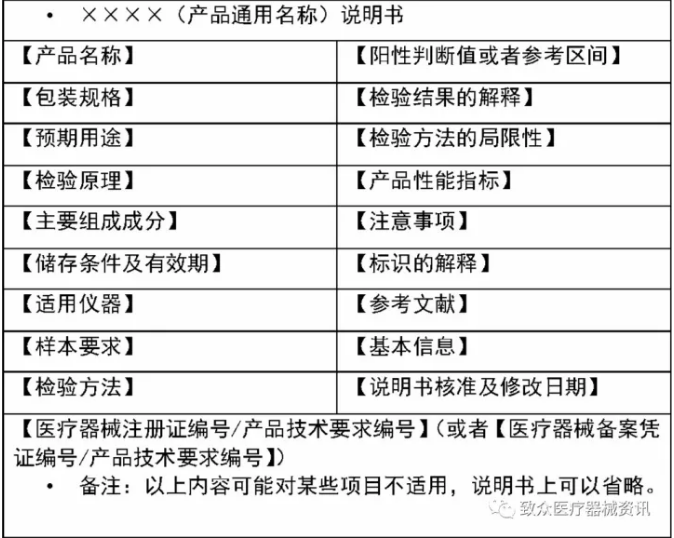
规范解读——体外诊断试剂
规范解读——其他要求

根据产品分类的不同,在说明书中附加四个表及相关说明。
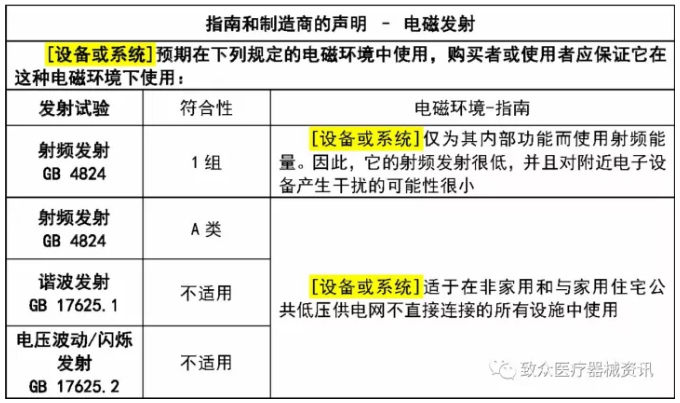
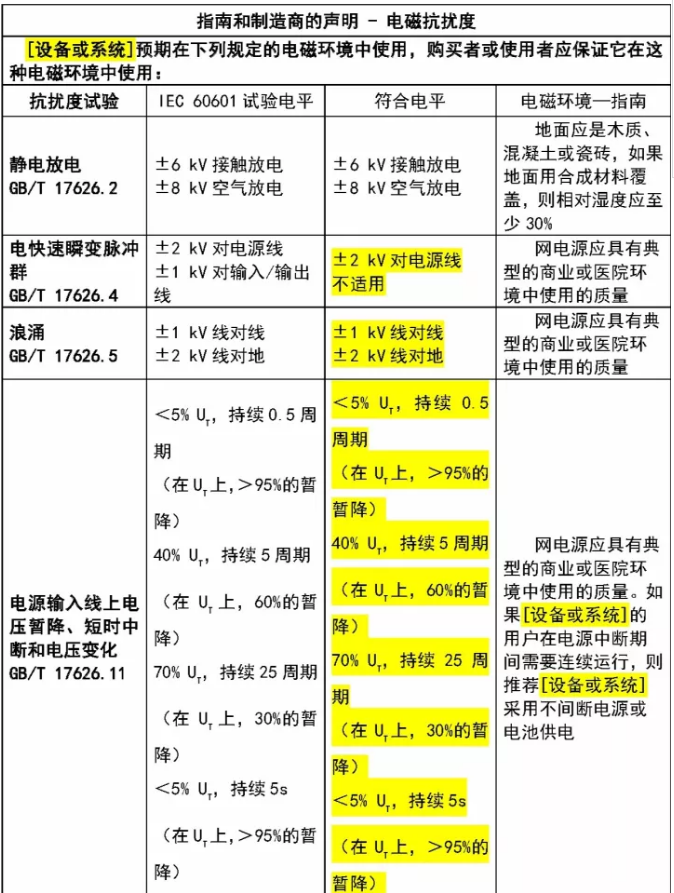

规范解读——其他要求
• 无源植入类骨关节产品说明书编写指导原则(征求意见稿)
• 常见无源植入类骨关节产品说明书示例(征求意见稿)
• 关于印发角膜塑形用硬性透气接触镜说明书编写指导原则的通知
• 软性亲水接触镜说明书编写指导原则
• 硬性角膜接触镜说明书编写指导原则
• 其他特定产品的产品注册技术审查指导原则
规范解读——关于变更

• 医疗器械说明书更改告知程序
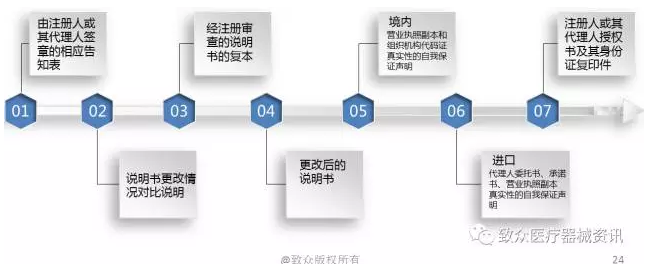
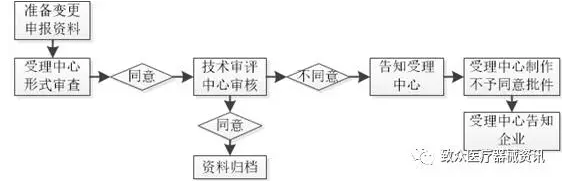
规范解读——说明书更改流程
规范解读——诊断试剂说明书变更
• 总局办公厅关于体外诊断试剂说明书文字性变更有关问题的通知食药监办械管〔2016〕117号
• 基本信息
– 体外诊断试剂的注册人或者生产企业联系方式、售后服务单位名称及联系方式、生产许可证编号或者生产备案凭证编号的变化,进口体外诊断试剂代理人联系方式变化的情况
• 医疗器械注册证编号/产品技术要求编号
– 相应食品药品监督管理部门发放医疗器械注册证后,导致该项内容变化的情况
• 标识的解释
– 按照YY/T 0466系列标准完善体外诊断试剂说明书中相应标识的解释内容,导致该项内容变化
• 主要组成成分
– 必须配套使用的医疗器械或体外诊断试剂,由于相应食品药品监督管理部门发放医疗器械注册证/备案凭证后,导致说明书中载明的配套使用的医疗器械或体外诊断试剂注册证编号/备案凭证编号发生变化的情况
规范解读——罚则
• 6号令
– 第十八条 说明书和标签不符合本规定要求的,由县级以上食品药品监督管理部门按照《医疗器械监督管理条例》第六十七条的规定予以处罚。
• 条例
– 第六十七条 有下列情形之一的,由县级以上人民政府食品药品监督管理部门责令改正,处1万元以上3万元以下罚款;情节严重的,责令停产停业,直至由原发证部门吊销医疗器械生产许可证、医疗器械经营许可证:
(一)医疗器械生产企业的生产条件发生变化、不再符合医疗器械质量管理体系要求,未依照本条例规定整改、停止生产、报告的;
(二)生产、经营说明书、标签不符合本条例规定的医疗器械的;
(三)未按照医疗器械说明书和标签标示要求运输、贮存医疗器械的;
(四)转让过期、失效、淘汰或者检验不合格的在用医疗器械的。
标识问题统计——质量公告
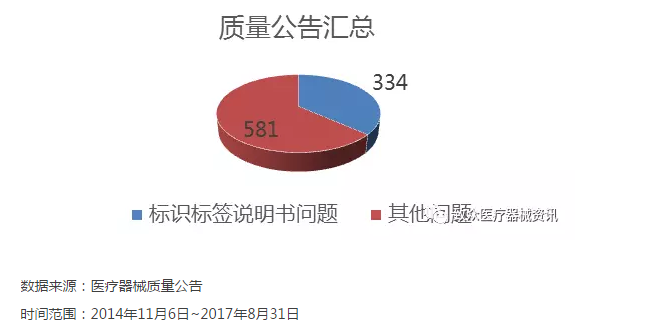
数据来源:医疗器械质量公告
时间范围:2014年11月6日~2017年8月31日
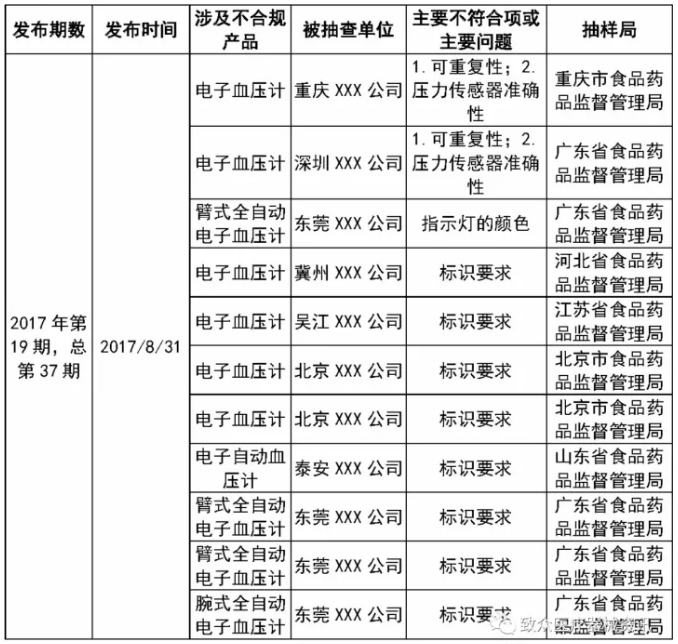
标识问题统计——关于电子血压计

标识问题统计——召回
• 出现了较多的因为标识标签说明书错误引起的召回
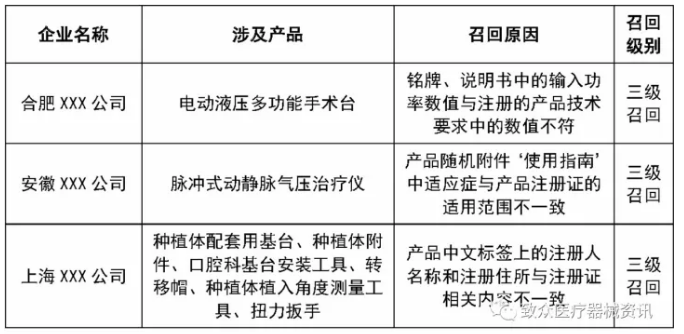
• 涉及到的处理措施
合规的说明书与标签范例
合规的说明书与标签范例
说明书(有源医疗器械)
• 前言
– 说明:列出产品基本信息,包括名称、型号、注册人相关信息(名称、地址、联系方式)、生产企业相关信息(名称、地址、联系方式)、生产许可证号、注册证号、产品技术要求编号、说明书修订日期
– 其他相关的声明:知识产权和其他相关的免责条款
• 正文
– 基本信息:预期用途、禁忌症、产品组成
– 产品介绍:产品基本的情况,原理,可用图示说明
– 安装说明:如何安装和连接各部件,可补充相关的警告和注意事项
– 使用说明:如何使用该医疗器械,如何操作,需要设置哪些参数和其代表的意义,可补充相关的警告和注意事项
– 产品维护:日常清洁维护、周期维护、厂家维护,可补充相关的警告和注意事项
– 运输和储存要求:产品运输和储存过程中的温湿度要求及相关警告和注意事项
– 故障处理:常见的故障代码及其含义
– 技术规格:技术参数
– 标识和符号的含义:标签和说明书中所用的符号和对其含义的说明
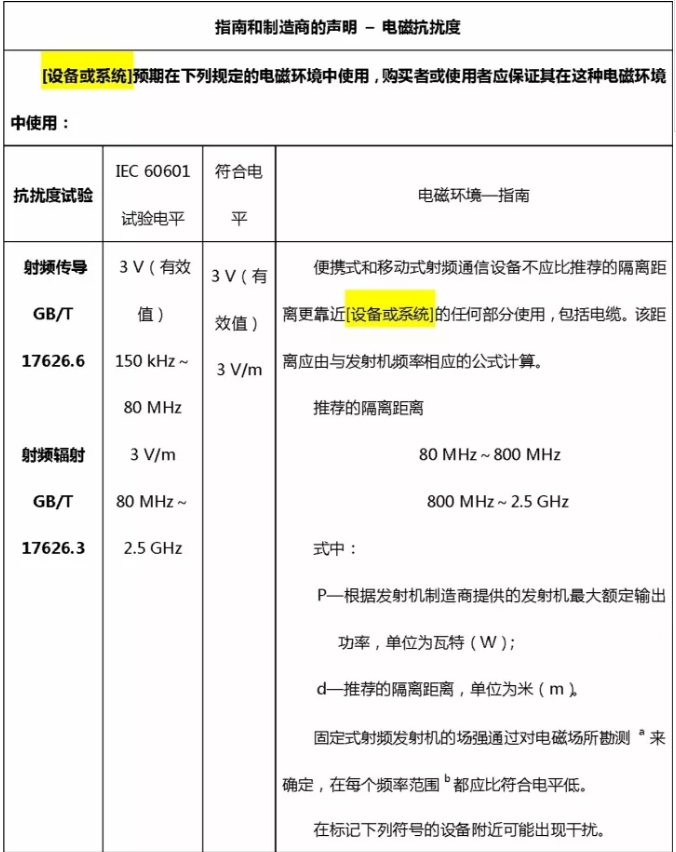
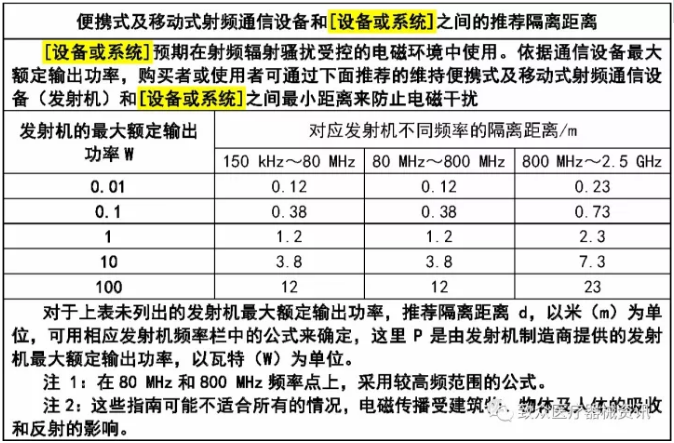
– 制造商声明和电磁兼容性导则
标签(有源医疗器械)
• 可按照6号令的要求逐项列出
• 需要补充9706和相关行标的特殊要求,例如:
– 电源连接条件
– 分类(设备类型、防电击程度分类)
– 生理效应(符号和警告性声明)
说明书和标签(无菌医疗器械)
• 说明书:
– 可按照六号令的要求逐条列出
– 可采取以下形式:
• 【产品名称】XXXX
• 【禁忌症】XXXX
– 注意特殊产品的标准和指导原则要求
• 标签:
– 可按照六号令的要求逐条列出
– 注意需要明确灭菌批号
说明书和标签(IVD产品)
• 说明书:
– 可按照指导原则的要求逐条列出
– 可采取以下形式:
• 【产品名称】
• 【包装规格】
• 【预期用途】
• 标签:
– 6号令要求
– 特别注意相关标准的要求