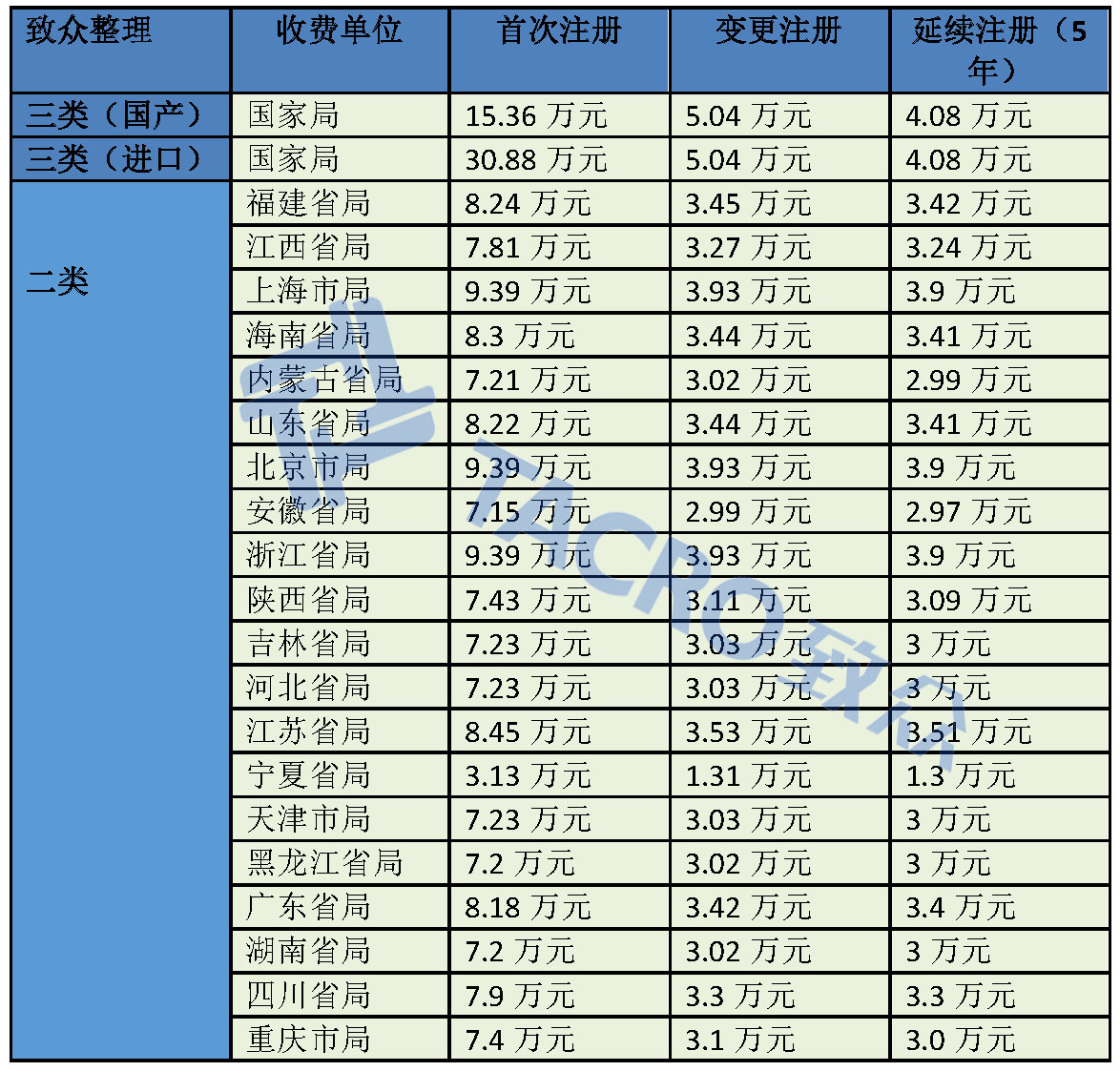
12月20日,重庆市食品药品监督管理局发布了《重庆市食品药品监督管理局关于发布药品、医疗器械产品注册收费标准的公告》,规定了境内第二类医疗器械产品的首次注册费用为74,300元,变更注册费用为31,100元,延续注册费用为30,900元。
该收费标准自2017年12月21日正式执行。
这是第20个省级药监部门施行医疗器械注册收费制度,以下是致众整理已经施行医疗器械注册收费制度的药监部门汇总:
重庆市食品药品监督管理局关于发布药品、医疗器械产品注册收费标准的公告
为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)精神,根据《国家发展改革委财政部关于印发药品、医疗器械产品注册收费标准管理办法的通知》(发改价格〔2015〕1006号)、《重庆市物价局重庆市财政局关于药品、医疗器械产品注册收费标准的复函》(渝价函〔2016〕157号),重庆市食品药品监督管理局制定了《重庆市药品、医疗器械产品注册收费标准(试行)》和《重庆市食品药品监督管理局药品、医疗器械产品注册收费实施细则(试行)》(详见附件),现予以公告。收费标准自2017年12月21日起执行。
附件:
1.重庆市药品、医疗器械产品注册收费标准(试行).docx
2.重庆市食品药品监督管理局药品、医疗器械产品注册收费实施细则(试行).docx
重庆市食品药品监督管理局
2017年12月20日
附件1
重庆市药品、医疗器械产品
注册收费标准(试行)
一、药品注册费
重庆市食品药品监督管理局依照法定职责,对新药、仿制药补充申请和再注册申请开展行政受理、现场检查/核查、技术审评等注册工作,并按标准收取有关费用。具体收费标准如下:
药品注册费收费标准
单位:元
|
项目分类 |
收费标准 |
|
|
补充申请注册费 |
常规项 |
5500 |
|
需技术审评的 |
26300 |
|
|
药品再注册费(五年一次) |
24800 |
|
注:(1)药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。
(2)《药品注册管理办法》中属于省级食品药品监管部门备案的药品补充申请事项,不收取注册费,如此类申请经审核认定为申请内容需要技术审评的,申请人应按照需要技术审评的补充申请的收费标准补交费用。
(3)注册申请受理后,申请人主动提出撤回注册申请的,或市食品药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
(4)药品注册加急费收费标准另行制定。
二、境内第二类医疗器械产品注册费
重庆市食品药品监督管理局依照法定职责,对辖区内第二类医疗器械(包括体外诊断试剂)产品首次注册、变更注册、延续注册申请开展行政受理、质量管理体系核查、技术审评等注册工作,并按标准收取有关费用。具体标准如下:
第二类医疗器械产品注册收费标准
单位:元
|
项 目 |
收费标准 |
|
首次注册费 |
74300 |
|
变更注册费 |
31100 |
|
延续注册费(五年一次) |
30900 |
注:(1)医疗器械产品注册收费按《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》确定的注册单元计收。注册申请人应当按第二类医疗器械注册单元提出产品注册申请并按规定缴纳费用,对于根据相关要求需拆分注册单元的,被拆分出的注册单元应当另行申报。
(2)《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于备案的登记事项变更申请,不收取变更注册申请费。
(3)注册申请受理后,申请人主动提出撤回注册申请的,或重庆市食品药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
(4)小微企业提出的第二类创新医疗器械产品首次注册申请,免收首次注册费。创新医疗器械产品是指由国家食品药品监督管理总局创新医疗器械审查办公室确定的产品。
(5)医疗器械产品注册加急费收费标准另行制定。
三、其它事项
对符合《重庆市财政局关于市级非税收入退付程序的通知》(渝财库〔2003〕41号)退付范围的注册费,由申请人向受理部门提交退付申请、汇缴款凭据、《非税收入一般缴款书》(收据联)复印件等有关材料(所有材料均需加盖申请单位印章)。退付程序每季度办理一次。