受理号:CQZ1700047
医疗器械产品注册技术审评报告
(境内)
产品中文名称:药物洗脱球囊导管
产品管理类别:第三类
申请人名称:辽宁垠艺生物科技股份有限公司
一、申请人名称:辽宁垠艺生物科技股份有限公司
二、申请人住所:大连市金州区光明街道汉正路 8-11 号
三、生产地址:大连市金州区光明街道汉正路 8-11 号
产品审评摘要
一、产品概述
(一)产品结构及组成
该产品为Rx型球囊扩张导管,由球囊、标志环、远端 杆、近端杆及导管座组成,其中远端杆涂有聚乙烯吡咯烷酮 涂层,并分为外管、内管和tip管。球囊由Pebax7233制成, 表面涂有药物涂层,涂层中所含药物为紫杉醇,药物剂量为 3.0μg/mm2,载药基质为碘海醇。产品一次性使用。
(二)产品适用范围
该产品适用于原发冠状动脉分叉病变狭窄的扩张。
(三)型号/规格
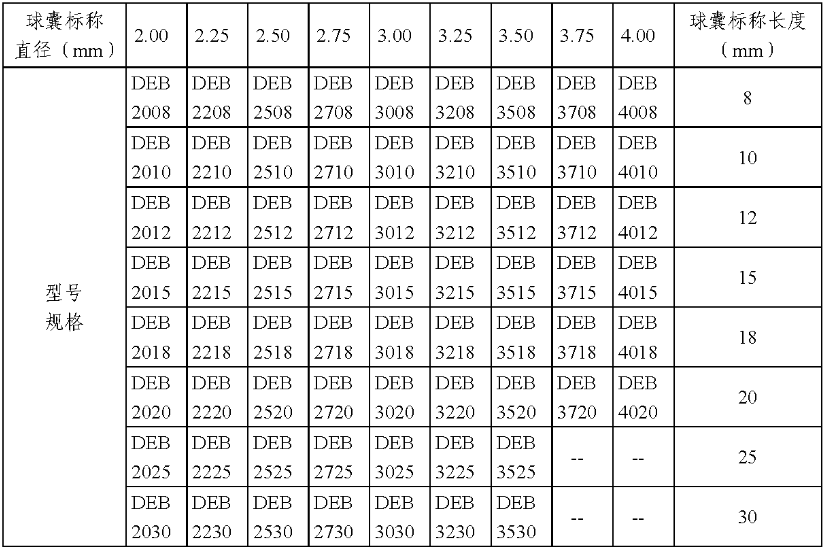
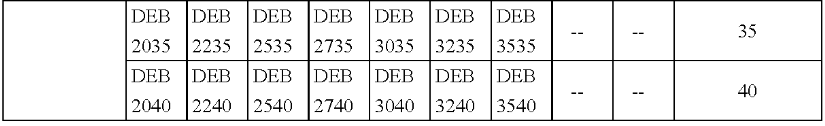
产品的型号规格见表1。
表1型号规格表
(四)作用机理
将产品输送至血管病变位置,通过球囊充压扩张,机械 性扩张血管的狭窄部位。血管成形术后易因血管内膜过度增 生等因素导致再狭窄,紫杉醇可阻断细胞增生早期启动因子,抑制细胞骨架生成,阻断有丝分裂,抑制细胞快速增殖,还 可抑制平滑肌细胞迁移和表型改变,抑制内膜增生性炎症反 应。该产品将紫杉醇同碘海醇混合后喷涂于球囊表面,通过 局部向冠状动脉血管壁释放抗增殖药物紫杉醇,抑制血管内 膜过度增生。
二、临床前研究摘要
(一)产品性能研究
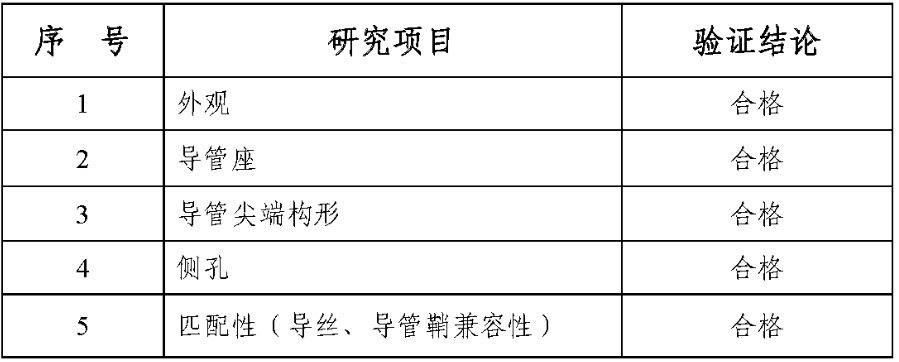
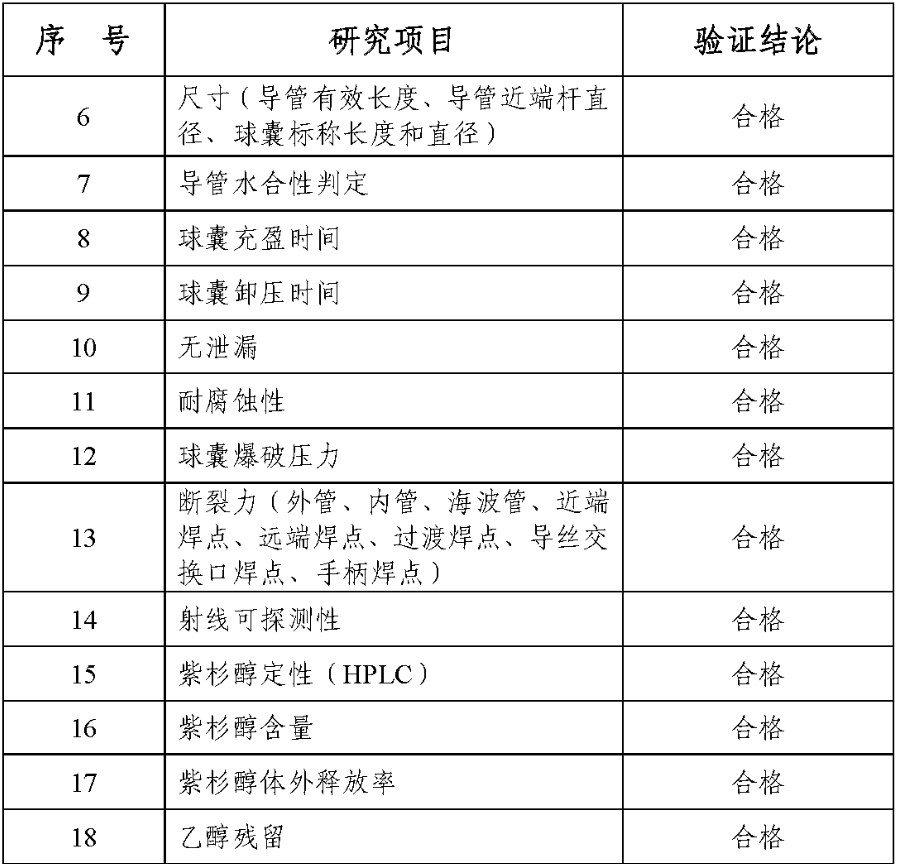
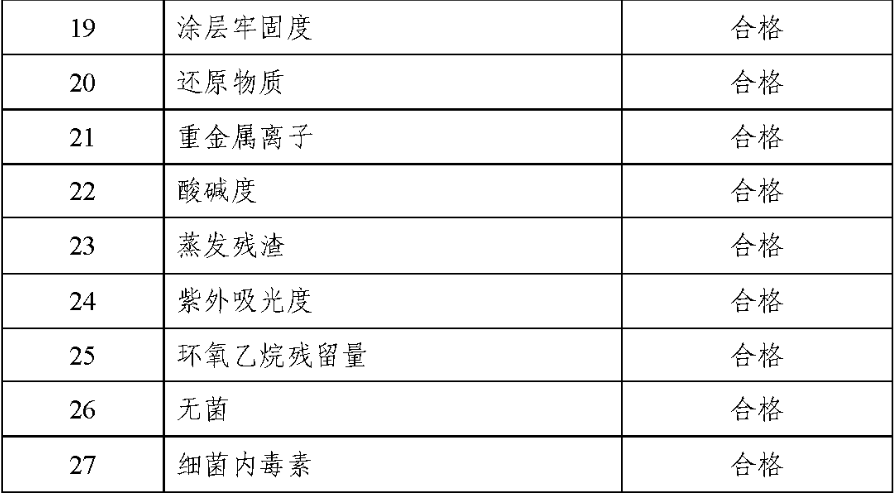
1.产品技术要求研究技术要求研究项目如表 2 所示:
表 2 技术要求研究摘要
2.产品性能评价
产品性能评价包括药物剂量选择、紫杉醇及碘海醇和器械间相互作用、球囊顺应性、模拟使用、涂层均匀性、球囊扩张时间和次数、2-氯乙醇残留量、灭菌对药物涂层的影响等研究,结果表明产品符合设计输入要求。
(二)生物相容性
该产品为外部接入器械,与循环血液短期接触。申请人 依据GB/T16886系列标准进行了生物相容性评价,选择开 展的生物学试验包括细胞毒性、迟发型超敏反应、皮内刺激、 急性全身毒性、溶血、血栓形成、凝血和热原,生物相容性 风险可接受。
(三)灭菌
该产品无菌状态提供,采用环氧乙烷灭菌。申请人提供了灭菌确认报告,证明无菌保证水平为10-6。环氧乙烷残留 量不大于10μg/g,2-氯乙醇残留量平均日剂量不超过9mg。
(四)产品有效期和包装
该产品货架有效期两年。申请人提供了有效期的验证报告,验证实验为实时和加速老化验证,包括产品稳定性、包装完整性验证。
(五)动物研究
实验目的为评价药物洗脱球囊导管在健康普通家猪冠 状动脉模型中24小时内的药物释放情况、产品使用性能及 安全性。评价指标包括球囊在血管内的推送能力、通过病变 部位的能力、球囊张开程度、球囊可视性、球囊贴壁性能、 球囊的回撤能力、球囊导入鞘的止血性、球囊引起血管夹层、球囊推送过程中打折、球囊使用总体评价、扩张后球囊剩余药量、靶血管吸收药量、血药浓度、大体解剖观察、TIMI血流、病理分析。动物实验结果表明,产品达到预期设计要求。
三、临床评价摘要
该产品以临床试验方式进行临床评价。临床试验目的为评价申报产品用于原发冠状动脉分叉病变狭窄的扩张的安全有效性。临床试验为前瞻性、多中心、随机对照的优效性设计。由于目前尚无相同适用范围的药物球囊产品上市,因此对照产品选择为普通球囊扩张导管(国械注准 20163770816)。
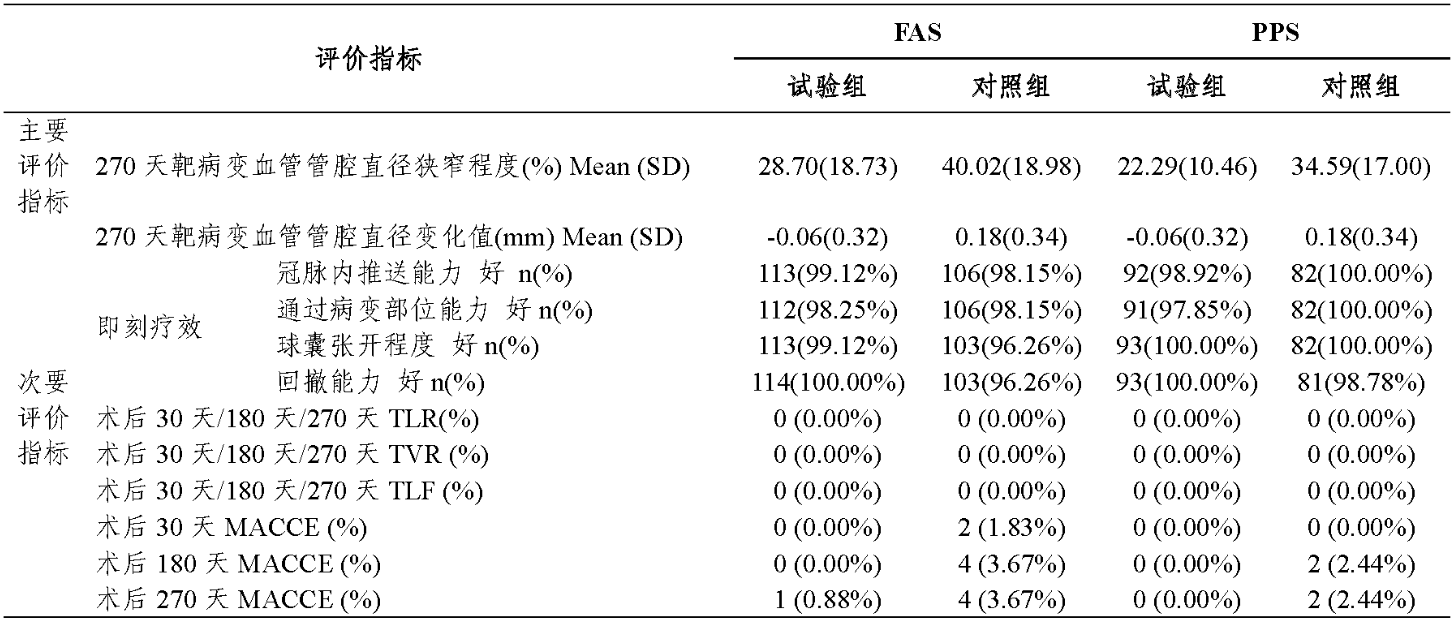
该临床试验在10家临床机构开展,实际入组222例(试 验组113例/对照组109例)原发冠状动脉分叉病变狭窄的患者。主要评价指标为术后270天靶病变血管管腔直径狭窄程 度(%),次要评价指标为即刻疗效、术后30天、180天和 270天的靶病变失败率(TLF)、靶病变血运重建率(TLR)、靶血管血运重建率(TVR)和主要不良心脑血管事件(MACCE)。全分析集(FAS)包含患者222例,其中试验组113例,对照组109例;符合方案集(PPS)包含患者174例,其中试验组92例,对照组82例;安全集(SS)包含患者222例,其中试验组113例,对照组109例。主要/次要评价指标结果如表3所示。结果表明,试验组和对照组术后270天靶病变血管管腔直径狭窄程度(%)有显著差异,95%可信区间估计表明优效性研究假设成立。
表3 临床试验主要/次要评价指标结果
安全性指标分析如表 4 所示,全因死亡、心源性死亡、非致死性心肌梗死、血栓事件等指标组间无统计学差异。
表 4 临床试验安全性评价指标结果(SS 集)
不良事件发生情况如表 5 所示,试验组与对照组间无统计学差异,与器械相关性分析结果为试验组与对照组间无统计学差异。
表 5 不良事件总体情况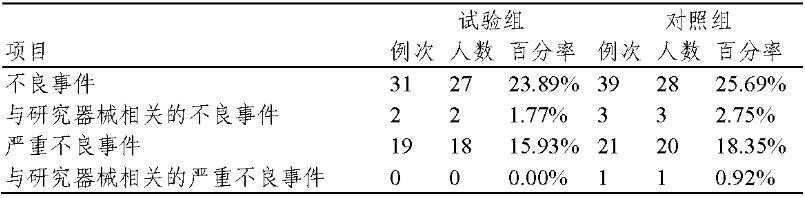
该产品在临床应用中通过对患者原发冠状动脉分叉病变的狭窄的扩张,预期增加心肌灌注,但可能伴随急性心肌 梗死、冠状动脉血管撕裂、夹层、变形、破裂或受损、冠状 动脉穿孔、冠状动脉痉挛、扩张血管的再狭窄等风险。根据 申请人提供的申报资料,经综合评价,在目前认知水平上, 认为该产品为患者带来的受益大于风险。
为进一步观察产品在真实世界中远期安全性和有效性, 注册人应在产品上市后开展临床研究,随访指标包括但不限于手术成功率、主要心脏不良事件、靶病变血运重建、靶病变失败率、死亡、心肌梗死和血栓等。
四、风险分析及说明书提示
参照《YY/T 0316-2016 医疗器械风险管理对医疗器械的 应用》对该产品进行了风险分析,对目前已知及可预测风险 采取了风险控制措施,为保证用械安全,需在说明书中提示以 下信息:
(一)明确的产品适用范围。
(二)警示及注意事项:
1.本产品只能由经过专门培训的医生使用。
2.使用本产品的医院必须具备在发生潜在损伤或出现危 及生命的并发症时能够快速、紧急处理的条件。
3.本产品一次性使用,禁止二次使用。
4.使用前,请不要打开初包装。
5.禁止使用过期和/或初包装破损的产品。
6.生产日期、使用期限、产品批号详见产品包装和标签。
7.如果产品扭曲或打折,禁止使用,也不要试图将其拉 直后使用,否则将可能导致其折断。如果出现以上情况,应 更换一个新的产品。
8.将本产品置入患者体内前,应检查其功能是否完好, 并确保球囊的尺寸和外形适合于预先制定的操作方案。
9.不可使用空气或任何气体作为球囊扩张的介质。
10.应使用带有压力表的球囊充压装置,以监测压力,防止过度加压。
11.为减少对血管的潜在损伤,球囊扩张后直径应与最接 近狭窄部位末端血管直径匹配。
12.对于不能接受冠状动脉搭桥手术的患者进行 PTCA 手术时需要充分考虑,包括 PTCA 过程中可能发生的再灌注 损伤,因为这类患者进行 PTCA 手术时伴随有特别的风险。
13.本产品置于血管系统中时,应在高分辨率医用血管造 影 X 射线机或具有同等功能的影像设备指导下操作。球囊未 完全缩扁前不要回撤。如果在操作过程中遇到阻力,应先确 定阻力原因方可进行下一步处理。
14.操作过程中,根据患者的需要应为其提供适当的抗血 小板/抗凝及冠状动脉血管扩张治疗。抗血小板/抗凝治疗持 续的时间由医生在手术结束后根据患者的情况决定。
15.尽可能以最短的时间将本产品输送至病变部位。
16.打开止血阀、关闭止血阀及撤出导管时都应考虑系统 直径差异的问题。
(三)禁忌症:
1.对造影剂有过敏史者。
2.对紫杉醇有过敏史者。
3.血液病或抗血小板和/或抗凝治疗禁忌者。
4.无临床缺血证据的临界性狭窄。
5.无明显狭窄的冠状动脉痉挛。
6.6 个月内有过脑卒中的患者。
7.6个月内有过严重的消化道出血或活动性胃溃疡者。
8.肝、肾、脑等重要器官功能异常者。
9.孕妇或哺乳期妇女。
综合评价意见
该申报产品属优先审批项目,编号 20170002。申请人的 注册申报资料符合现行要求。依据《医疗器械监督管理条例》(国务院令第 680 号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令 2014 年第 4 号)等相关医疗器械法 规与配套规章,经系统评价后,建议准予注册,同时产品上市 后应开展临床研究以观察真实世界中远期安全性和有效性。