2017年度,国家食品药品监督管理总局(以下简称CFDA),先后发布了222款产品不予注册的通知。
从产品类别上来看,在222款产品当中,共有112款无源类,63款有源类,以及47款体外诊断试剂。其中,无源产品独占总数的50%(如图一)。
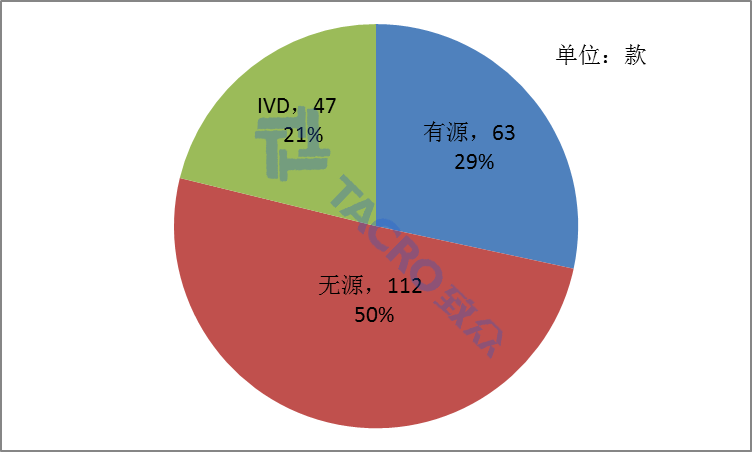
图一 各类不予注册产品数量对比图
2017年不予注册的产品中,国产产品共121款,占总数的55%;进口产品共101款,占总数的45%(如图二)。
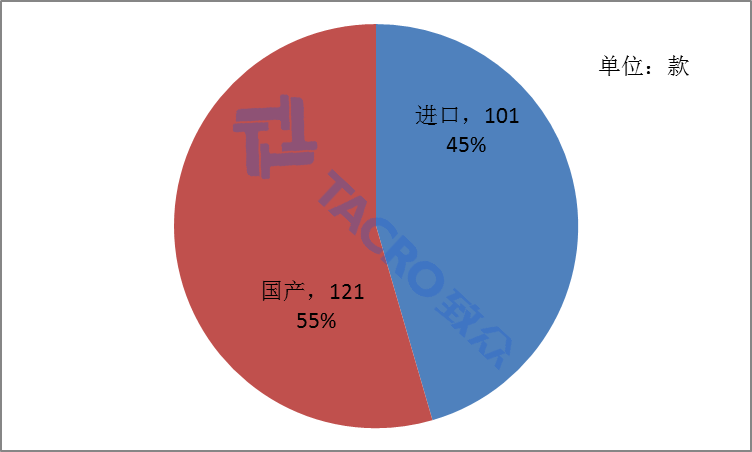
图二 国产进口数量对比图
从地区分布上来看,北京、广东、上海三地作为医疗器械生产大省(市),不予注册数量同样最多,分别达到24款、23款以及18款(如图三)。
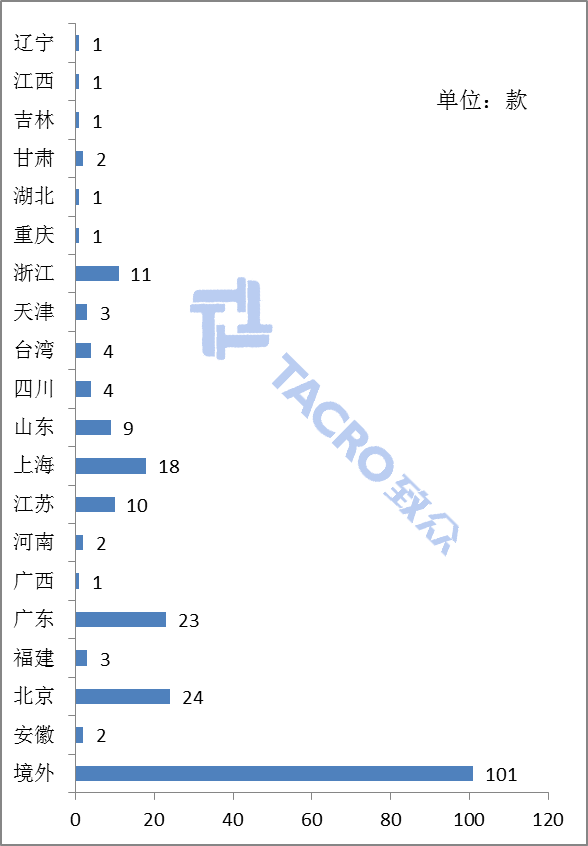
图三 各个地区不予注册数量对比图
依据《医疗器械注册管理办法》(局令4号),对于存在以下条款中提到问题的产品,将作出不予注册的决定:
第三十五条 申请人逾期未提交补充资料的,由技术审评机构终止技术审评,提出不予注册的建议,由食品药品监督管理部门核准后作出不予注册的决定。
第三十九条 对于已受理的注册申请,有下列情形之一的,食品药品监督管理部门作出不予注册的决定,并告知申请人:
(一)申请人对拟上市销售医疗器械的安全性、有效性进行的研究及其结果无法证明产品安全、有效的;
(二)注册申报资料虚假的;
(三)注册申报资料内容混乱、矛盾的;
(四)注册申报资料的内容与申报项目明显不符的;
(五)不予注册的其他情形。
第四十一条 对于已受理的注册申请,有证据表明注册申报资料可能虚假的,食品药品监督管理部门可以中止审批。经核实后,根据核实结论继续审查或者作出不予注册的决定。
本文系原创,未经授权,禁止转载