医疗器械产品注册
技术审评报告
(境内)
产品中文名称:miR-92a 检测试剂盒(荧光RT-PCR 法)
产品管理类别:三类
申请人名称:深圳市晋百慧生物有限公司
国家食品药品监督管理总局
医疗器械技术审评中心
基本信息
一、申请人名称
深圳市晋百慧生物有限公司
二、申请人住所
深圳市南山区桃源街道田寮工业A 区9 栋二楼西面
三、生产地址
深圳市南山区桃源街道田寮工业A 区9 栋二楼西面
深圳市南山区桃源街道田寮工业A 区田寮大厦1503
产品审评摘要
一、产品概述
(一)产品主要组成成分
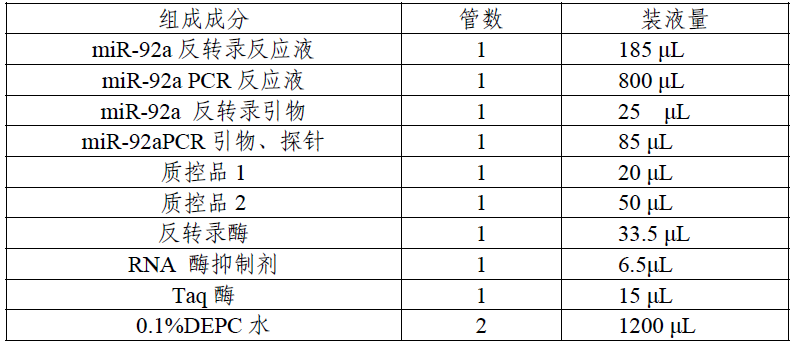
该产品配套使用的核酸提取试剂为深圳市晋百慧生物有限公司生产的核酸提取试剂, 备案号为: 粤深械备20150228 号。
(二)产品预期用途
该产品用于体外定性检测人粪便样本中的miR-92a 核酸。
该产品用于便潜血阳性、综合其他症状如排便习惯改变、大便形状变化、慢性便秘、排便里急后重等经临床医生诊断建议肠镜检查同时由于不同原因拒绝进行肠镜检查的患者,用于临床对大肠癌的辅助诊断。检测结果阳性不作为大肠癌早期诊断或确诊的证据,检测结果阴性也不能排除大组成成分管数装液量肠癌的可能,患者最终诊断应依据肠镜检查结果。该产品不用于普通人群的肿瘤筛查。
大肠癌按《恶性肿瘤TNM 分类法》分为0 期,I 期,II期,III 期,IV 期,早期一般呈现如排便习惯改变、大便形状变化、大便带血、慢性便秘、排便里急后重等症状,但常因症状轻微和不典型而被忽视。miR-92a 来自人类13 号染色体上的miR-17-92 基因簇,是一类小分子非编码RNA。miR-92a 通过靶向抑制PTEN、KLF4 和下游的p21 基因,可促进大肠癌细胞的增殖和迁移。研究发现,在大肠癌患者粪便样本中miR-92a 含量特征性增高。
(三)产品包装规格
48 人份/盒
(四)产品检验原理
miR-92a 检测试剂盒(荧光RT-PCR 法)是采用RNA 提取试剂盒提取粪便中的RNA,进行RT-PCR 反应,反应中的引物、探针能够与miR-92a 反转录产物特异性结合并进行PCR 扩增,在扩增过程中探针与含miR-92a 模板的反转录cDNA 链互补结合后,探针5’端荧光染料基团被Taq 酶切下并释放荧光信号,被检测到的荧光信号强弱可以反映样本中miR-92a 的含量。
二、临床前研究摘要
(一)主要原材料
1.主要原材料的种类
该试剂盒主要原材料包括:Taq 酶、反转录酶、miR-92a反转录引物、miR-92a 上游引物、miR-92a 下游引物、miR-92a探针、miR-92a 基因RNA 片段、dNTP、RNA 酶抑制剂。
2.主要原材料的选择
2.1 外购的主要原材料包括:Taq 酶、反转录酶、dNTP、RNA 酶抑制剂。通过使用各成分配制反应体系,以大肠癌阳性粪便样本进行功能性试验,筛选最佳供应商。
2.2 自行设计的主要原材料包括:miR-92a 反转录引物、miR-92a 上游引物、miR-92a 下游引物、miR-92a 探针、miR-92a基因RNA 片段。通过功能性试验进行确认。
申请人设计了完整的企业参考品,包括阳性参考品、阴性参考品、检测限参考品、精密度参考品、线性范围参考品、干扰物质参考品。阴性参考品包括肠癌阴性粪便样本、食道癌患者粪便样本、胃癌患者粪便样本;阳性参考品、精密度参考品、干扰物质参考品采用大肠癌粪便样本;检测限参考品、线性范围参考品采用合成的miR-92a 基因RNA 片段稀释配制而成, 检测限参考品浓度为1×104copies/μL 的miR-92a 基因RNA 片段, 线性范围参考品浓度为1×107copies/μL 的miR-92a 基因RNA 片段。各项企业参考品综合用于产品检测灵敏度、特异性和重复性评价。试剂盒内质控品包括质控品1 和质控品2,质控品1 含有miR-92a 基因RNA 片段,质控品2 为0.1%DEPC 水,用于检测过程中的质量控制
(二)生产工艺及反应体系研究
1. 反转录
申请人对PCR 反应体系中各主要原料(反转录酶、反转录引物、RNA 酶抑制剂、dNTP、MgCl2、PCR 反应缓冲液)的浓度及用量,以及反转录程序进行优化试验,确定了最佳的反转录试剂的生产工艺及反应体系。
2.荧光PCR 扩增
申请人对PCR 反应体系中各主要原料(Taq 酶、MgCl2、dNTP、引物、探针、PCR 反应缓冲液、50% 甘油)的浓度及用量以及PCR 反应程序进行优化试验,确定了最佳的荧光PCR 扩增试剂的生产工艺及反应体系。
3.申请人也对RNA 浓度、反转录模板量、PCR 模板量、粪便样本量、样本采集方法进行了研究,进一步确定了试剂盒反应体系的各项参数和指标。
(三)分析性能评估
该产品分析性能包括检测限、阴性符合率、阳性符合率、精密度、干扰物质、线性范围等。
最低检测限评估中,申请人采用高浓度miR-92a 阳性参考品梯度稀释于提取的不含miR-92a 基因的粪便样本中,分别进行25 次重复检测,得到检出率为95%的浓度水平为100copies/μL 作为本试剂的最低检测限。阳性符合率评估中,申请人采用临床确诊为大肠癌早期患者、大肠癌中期患者、大肠癌晚期患者粪便样本各5 份来进行检测,检测结果显示阳性符合率达到100%。在精密度研究中,申请人采用晚期和中期大肠癌患者粪便样本,评价了本产品批内及批间精密度,结果显示三批试剂的批内和批间检测Ct 值CV%均不高于5%。
阴性符合率评价中,申请人针对miR-92a 基因与其他同源基因和miR-92a 阴性样本非特异反应进行评价,样本包括食道癌患者粪便样本、胃癌患者粪便样本、息肉患者粪便样本、腺瘤患者粪便样本、胃炎患者粪便样本、肠炎患者粪便样本、阑尾炎患者粪便样本、结肠炎患者粪便样本、消化性溃疡患者粪便样本、肝癌患者粪便样本、胰腺癌患者粪便样本、胆管癌患者粪便样本、口腔癌患者粪便样本及大肠癌阴性样本。经验证食道癌样本、胃癌样本、息肉样本、腺瘤样本、胃炎样本、肠炎样本、阑尾炎样本、结肠炎样本、消化性溃疡样本、肝癌样本、胰腺癌样本、胆管癌样本、口腔癌样本与该产品未见交叉反应,与miR-92a 阴性样本未产生非特异反应,与常见的miR-135b 和miR-21 基因不产生交叉反应,与人体细胞组织中的GAPDH 基因、β-actin 基因以及U6基因等DNA 不产生交叉反应。
干扰试验结果显示大肠癌粪便水状样本不能用于检测;带血粪便样本中,样本中血红蛋白含量超过>8.0mg/mL 后,不能用于检测;粪便样本中胆红素含量≤0.2mg/g 时,血清白蛋白含量≤10mg/g 时,对检测结果不会产生影响;粪便样本中白细胞含量≤4×106 个/mL 对检测结果不会产生影响;粪便样本中维生素C 含量≤14μg/g、尼莫司汀含量≤50 μg/g、盐酸吉西他滨含量≤5mg/g、苯丁酸氮芥含量≤120μg/g 时,对检测结果不会产生影响。
线性范围评估中,申请人采用高浓度miR-92a 阳性参考品梯度稀释于提取的不含miR-92a 基因的粪便样本中,分别重复检测3 次,得出线性相关系数r2≥0.980 的线性范围为102copies/μL-106 copies/μL。针对核酸提取纯化步骤,申请人对其生产的核酸提取试
剂进行研究,结果显示该试剂盒核酸提取效率大于90%,提取样本用于试剂盒检测性能良好。通过以上评价,选择晋百慧公司生产的核酸提取试剂(备案号为:粤深械备20150228号)作为该产品核酸提取纯化方法。
本次申报产品包装规格为48 份/盒,申请人提供了六批产品(批号为:20131201、20131202、20131203、20161001、20161002、20161003)在所有适用机型上的性能评估资料。
(四)阳性判断值
通过深圳人民医院提供的健康人的粪便样本150 例、大肠癌患者样本120 例,同时从香港中文大学获得49 例正常人粪便样本、76 例大肠癌患者粪便样本、36 例息肉患者粪便样本、30 例肝癌患者粪便样本、30 例肠炎患者粪便样本、30 例食道癌患者粪便样本、30 例胃癌患者粪便样本、30 例腺瘤患者粪便样本、30 例胃炎患者粪便样本、30 例阑尾炎患者粪便样本、30 例结肠炎患者粪便样本、30 例消化性溃疡患者粪便样本、30 例胰腺癌患者粪便样本、30 例胆管癌患者粪便样本、30 例口腔癌患者粪便样本,采用miR-92a 检测试剂盒(荧光RT-PCR 法)对其进行检测,检测结果采用SPSS15.0 统计分析软件进行ROC 曲线分析,根据约登指数的分析结果,取约登指数最大所对应的Ct 值为阳性判断值(Cut-off)为30.75。试剂盒有效性判定:
1.质控品1:Ct 值在30.70-32.3 范围内且有明显指数增长期;
2.质控品2:Ct 值>36.00 或无Ct 值,线形为直线或轻微斜线,无明显指数增长期;
以上结果符合要求,检测结果才有意义;否则,应重复检测。
结果判定:
1.样本的Ct 值>30.75 时,检测结果判定为阴性;
2.样本的Ct 值≤30.75 时,检测结果判定为阳性。
(五)稳定性
申请人对该产品实时稳定性、开瓶稳定性、冻融稳定性进行了系统的研究,确定了在各种条件下本产品的有效保存时间。
其中针对实时稳定性研究,采用三批次试剂盒(批号:20131201、20131202、20131203)储存于-20℃条件下,分别在0、3、6、9、12、15 个月进行准确度、分析特异性、精密度、检测限以及干扰物质检验,12 个月后各项指标符合成品质量要求,确定产品在-20℃条件下,可稳定保存12 个月。
开瓶稳定性采用三批次试剂盒(批号:20131201、20131202、20131203)开瓶后至于-20℃条件下冷冻保存,在有效期的第六个月和第十二个月后分别对其准确度、分析特异性、精密度、检测限以及干扰物质进行检验,产品各项指标符合成品质量要求,因此开瓶稳定性为12 个月。
冻融稳定性采用三批次试剂盒(批号:20131201、20131202、20131203)开瓶后至于室温下解冻,待其完全解冻并放置约15 分钟左右后,置于-20℃以下冷冻,每冻融2次分别对其准确度、分析特异性、精密度、检测限以及干扰物质进行检验,总共冻融8 次,在冻融6 次后产品各项指标符合成品质量要求,但在反复冻融8 次后部分性能指标不符合成品质量要求,根据以上实验结果确定产品的冻融次数不得超过6 次。
三、临床评价摘要
申请人在天津市人民医院、深圳市人民医院、中山大学肿瘤防治中心共3 家临床试验机构完成了临床试验。采用待考核试剂与诊断该疾病的“金标准”全结肠镜诊断检查进行同步比较的方法,验证本产品的临床性能。
检测人群包括:
1.通过地方筛查所有便潜血检测阳性患者在临床试验机构进行肠镜检查,同时所有阳性患者留取粪便样本采用本试剂盒进行检测。便潜血检测阳性患者共459 例,其中肠镜确诊的大肠癌阳性病例共计56 例,其余病例为健康人和其他良性疾病患者。
2.门诊经临床医生诊断需进行肠镜检查的初诊患者263例,患者症状主要包括排便习惯改变、大便形状变化、大便带血、慢性便秘、排便里急后重等症状。以上所有患者在进行肠镜检查前留取粪便样本采用本试剂盒进行检测,肠镜确诊的大肠癌阳性病例共计36 例,其余病例为健康人和其他良性疾病患者。
3.大肠癌术前住院患者248 例,为门诊患者主诉上述症状或其他检查怀疑大肠癌且经肠镜检查确诊为大肠癌,手术前留取患者粪便进行本试剂盒检测。
4.其余病例:其他消化系统肿瘤患者(治疗前)包括食管癌、胃癌、肝癌、胰腺癌、胆管癌、口腔癌,通过病理进行诊断,于治疗前采集粪便样本进行检测;相关良性疾病患者包括胃炎、肠炎、阑尾炎、结肠炎、消化性溃疡、大肠息肉、腺瘤;以及大肠癌术后住院患者65 例。
共入组1306 例样本,其中以上人群中通过肠镜检查最终确诊为大肠癌的患者共340 例,通过肠镜确诊为大肠癌阴性的患者901 例,大肠癌术后患者65 例。同时进行了179 例样本的测序检测,以验证检测的准确性,测序结果显示检测序列与设计序列一致。
临床试验结果:
三家临床试验机构共入组340 例大肠癌患者,采用待考核试剂对不同大肠癌分期患者样本检测结果见表1。
表1 大肠癌临床分期样本检测结果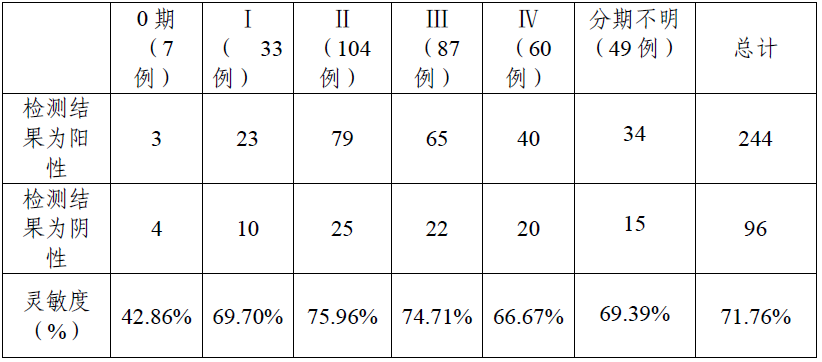
三家临床试验机构共入组59 例腺瘤患者,采用待考核试剂检测结果阳性8 例,特异性86.44%;共入组20 例胰腺癌患者,采用待考核试剂检测结果阳性0 例,特异性100%;
共入组20 例胆管癌患者,采用待考核试剂检测结果阳性1例,特异性95.00%;共入组20 例肝癌患者,采用待考核试剂检测结果阳性1 例,特异性95.00%;共入组20 例口腔癌患者,采用待考核试剂检测结果阳性1 例,特异性95.00%;共入组20 例食管癌患者,采用待考核试剂检测结果阳性0例,特异性100%;共入组25 例胃癌患者,采用待考核试剂检测结果阳性2 例,特异性92.00%。
三家临床试验机构共入组45 例肠炎患者,采用待考核试剂检测结果阳性3 例,特异性93.33%;共入组29 例结肠炎患者,采用待考核试剂检测结果阳性2 例,特异性93.10%;
共入组24 例消化性溃疡患者,采用待考核试剂检测结果阳性1 例,特异性95.83%;共入组180 例息肉患者,采用待考核试剂检测结果阳性14 例,特异性92.22%;共入组20 例阑尾炎患者,采用待考核试剂检测结果阳性1 例,特异性95.00%;共入组20 例胃炎患者,采用待考核试剂检测结果阳性1 例,特异性95.00%。
三家临床试验机构共入组65 例大肠癌术后患者,采用待考核试剂检测结果阳性11 例,阳性率16.92%。综合所有试验数据分析,以全结肠镜诊断金标准为参照,本产品检测灵敏度为71.76%,特异性为90.23%。检测结果与临床诊断金标准符合率较好,结果见表2
表2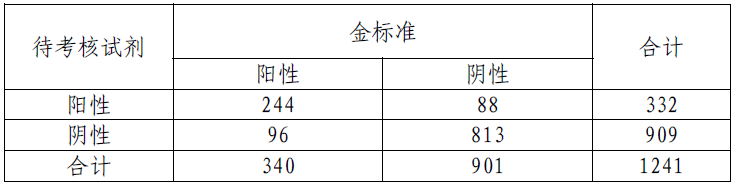
注:65 例术后病例未纳入表中作统计分析。
灵敏度: [244/(244+96)]*100%=71.76%
特异性: [813/(813+88)]*100%=90.23%
四、风险分析及说明书提示
参照“YY/T 0316-2016 医疗器械风险管理对医疗器械的应用”标准,对该产品进行风险分析。经综合评价,miR-92a检测试剂盒(荧光RT-PCR 法)已知和可预见的安全风险主要有以下几个方面:
1.与生物学危害有关的安全风险,例如原料之间的交叉污染。
2.与环境有关的危害,例如生产中的废液没有分类处理。
3.与使用有关的安全风险,例如使用仪器和试剂时没有按照说明书要求进行操作。
4.与运输与储存有关的安全风险,例如试剂的运输和储存超出规定条件。
5.与预期用途有关的安全风险,例如本产品的检测结果非唯一诊断依据,医生未结合其他诊断方法进行综合诊断。
6.功能性失效引起的安全风险,例如未按取样要求取样。
7.与生产有关的安全风险,例如使用未经过验证的原材料。通过环境控制、生产监控、原材料管理、成品检验和增加说明书警示内容等防范措施,对该产品的已知和可预见的安全风险进行控制和降低,剩余风险可以被控制在验收准则规定的可接受范围内,同时没有带来新的危害与安全风险。在目前认知水平上,认为该产品上市带来的获益/受益大于风险。
尽管目前认为该产品的受益大于风险,但为保证用械安全,基于对主要剩余风险的防控,已在产品说明书中提示以下信息:
1. 该产品用于体外定性检测人粪便样本中的miR-92a核酸。
该产品用于便潜血阳性、综合其他症状如排便习惯改变、大便形状变化、慢性便秘、排便里急后重等经临床医生诊断建议肠镜检查同时由于不同原因拒绝进行肠镜检查的患者,用于临床对大肠癌的辅助诊断,检测结果阳性不作为大肠癌早期诊断或确诊的证据,检测结果阴性也不能排除大肠癌的可能,患者最终诊断应依据肠镜检查结果。该产品不用于普通人群的肿瘤筛查。
2. 警示及注意事项:产品说明书中介绍了该产品检验方法的局限性及使用中的注意事项。
综合评价意见
本申报项目为境内第三类医疗器械产品注册,属于创新审批项目(编号:201600047)。申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第680 号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令2014 年第5 号)等相关医疗器械法规与配套规章,经系统评价后,建议准予注册。