中国境内和/或境外公开发表的科学文献和合法获得的相应数据——
临床文献数据
临床经验数据
文献数据
文献检索和筛选要素
↓
制定文献检索和筛选方案
↓
编制文献检索和筛选报告
建议考虑的文献检索和筛选要素
一、检索数据库
注册申请人需根据申报产品的具体情况(如设计特征、适用范围等)选择检索数据库,并在方案中论述选择的理由。数据库的选择应具有全面性,可考虑的数据库类型举例如下。
1.科学数据库:如美国《医学索引》(Medline)、荷兰《医学文摘》(EM)、中国期刊全文数据库等。
2.临床试验数据库:如科克伦对照试验注册中心(CENTRAL)、临床试验注册资料库(ClinicalTrials.gov)等。
3.系统评价数据库:如科克伦(Cochrane)图书馆等。
4.专业数据库:如诊断测试索引数据库(MEDION)、骨关节登记数据库等。
二、检索途径、检索词、检索词的逻辑关系
为全面、准确的检索出申报产品的临床文献,应综合考虑检索途径的选择、检索词的选择和各检索词间逻辑关系的配置,制定科学的检索策略。常见的检索途径包括主题词检索、关键词检索、摘要检索、全文检索等。检索词应与选择的检索途径相适应,考虑因素如产品的通用名称、商品名称、生产企业、基本原理、结构组成、制造材料、设计特征、关键技术、适用范围等。进行检索词逻辑组配时, 应正确地选用逻辑算符来表达检索词之间的逻辑关系,如逻辑或(OR)扩大检索范围,逻辑与(AND)缩小检索范围。应在检索方案中论述检索途径、检索词、检索词逻辑关系的确定理由。
三、文献筛选流程和筛选标准
对于检出文献的筛选,建议按照图1设定的步骤进行。注册申请人根据文献的题名和摘要,筛选出可能符合要求的文献;根据文献全文,筛选出纳入分析的文献;根据全文仍不能确定是否纳入分析的文献,需与作者联系以做出判断。
文献的筛选标准,即文献的纳入和排除标准,应明确、具有可操作性。
四、文献检索和筛选结果的输出
文献检索和筛选结果的输出采用文献的引用形式且需保持格式的一致性,文献的引用形式包括作者、题名、期刊名称、发表年代、卷数(期数)、页码等。经筛选纳入临床评价的文献应提供全文。
文献检索和筛选方案
器械名称: 型号规格: 检索的时间范围: 检索数据库:
检索数据库的选择理由: 检索途径:
检索词:
检索词的逻辑组配:
检索途径、检索词、检索词的逻辑组配的确定理由:
检索结果的输出形式:
文献筛选流程:
文献的筛选标准:
文献的筛选标准的制定理由:
文献筛选结果的输出形式:
文献检索和筛选人员姓名:
文献检索和筛选报告
器械名称:
型号规格:
检索的时间范围:
检索数据库:
检索途径:
检索词:
检索词的逻辑组配:
检索结果的输出:
检索偏离的描述、原因及对结果的影响:
文献筛选流程:
文献的筛选标准:
排除的文献:
排除理由:
文献筛选结果的输出:
筛选偏离的描述、原因及对结果的影响:
注:检索和筛选出的文献建议以“作者 题名 期刊名称 发表年代 卷数(期数) 页码”的格式列表。
文献检索和筛选人员签名:
时间:
临床经验数据
已完成的临床研究数据、不良事件数据、与临床风险相关的纠正措施数据——
已完成的临床研究数据
收集并提供伦理委员会意见(如适用)、临床研究方案和临床研究报告
不良事件数据
注册申请人建立的投诉和不良事件资料库
以及各国监管机构发布的不良事件资料库中相应不良事件数据
—国家食品药品监督管理总局《医疗器械不良事件信息通报》、《医疗器械警戒快讯》
—美国食品药品管理局申请人与用户机构设备使用数据库(MAUDE)
—英国医疗器械警报(MDA)等
不良事件数据
提供同品种医疗器械
—投诉及不良事件数量
—投诉及不良事件的原因归类
—各类别原因的投诉及不良事件数量、投诉及不良事件是否与产品有关等信息
对于严重不良事件,应以列表的形式提供事件描述、原因分析、处理方式等具体信息
对于申报产品还需提供产品在各国上市时间、累积销售量、严重不良事件处理结果等具体信息。
与临床风险相关的纠正措施数据
同品种医疗器械与临床风险相关的纠正措施(如召回、公告、警告等)的具体信息、采取的风险控制措施等信息
同品种医疗器械临床数据分析评价
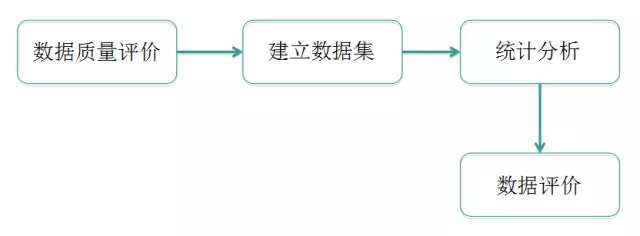
数据的质量评价
注册申请人应将纳入分析的数据按照公认的临床证据水平评价标准进行分级。
对于不适于进行产品有效性评价的部分临床数据,如适用,可用于产品安全性评价。
—(如牛津循证医学中心制定的临床证据水平评价标准等)
几个循证医学的概念
循证医学证据
—通过数据库可以检索到的临床文章,包括随机对照试验、队列研究、病例对照研究、系列病例研究、病例报告、传统综述、专家观点或经验等。
循证医学证据体系(evidence body)
—多种研究方法、多种来源的证据构成体系,它是随着时间推移,由各国临床医生总结自己的工作实际而形成的
证据等级(hierarchy of evidence)
—为什么要划分证据等级?这是因为不同的证据从科研意义上看其证据强度(strength of evidence)不同。对海量文献进行分级,就可以帮助我们找到最好的证据。
证据强度
—论证强度,是指研究结果的真实性和可推广应用性。就干预性试验来说,研究设计、方法、对象、干预、结局不同,研究的真实性就不一样。
推荐强度
—通过对证据的分级和评价,研究者对了应用其结果的可行性提出的推荐性意见。
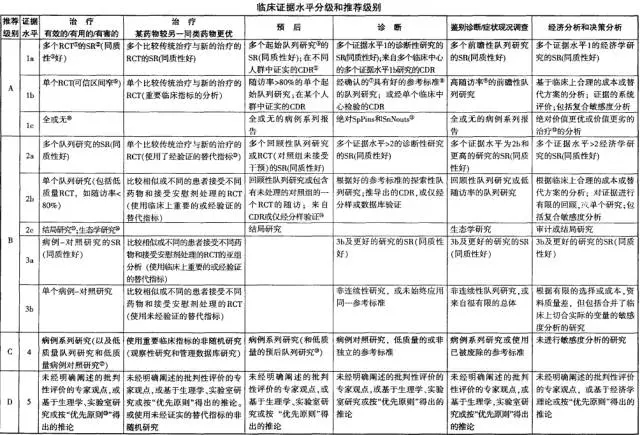
目前被广泛接受和使用的证据等级划分标准
牛津大学循证医学中心(Oxford Centre for Evidence Based Medicine) 的证据等级标准
GRADE 标准
牛津循证医学中心临床证据水平分级和推荐级别
2001年5月牛津循证医学中心制定的证据水平评价标
基于研究设计论证因果关系的力度不同将证据水平分为5级
推荐建议则根据证据质量、一致性、临床意义、普遍性、适用性等将推荐意见分为 A (优秀) 、B (良好) 、C (满意) 、D (差) 4 级
引入了分类的概念,把临床问题分成治疗,预防,病因,诊断,预后,危害,经济学七个方面,同时是结合了单签可得到的证据类型和分类标准进行了调整和细化,使其更具有针对性和适用性

同质性:指包括在一个系统综述中的各项研究,其结果的方向和程度一致
数据集的建立
根据数据类型、数据质量的不同,可将收集的临床数据归纳成多个数据集
亦可根据不同的评价目的分别建立数据集,
—如某些产品的临床性能和/或安全性存在人种差异,为评价中国人群使用该产品的安全性和/或有效性,可建立中国人群的数据集。
数据的统计分析
需选择合适的数据分析方法对不同的数据集进行统计分析
多个研究结果组成的数据集的分析方法包括定性分析和定量分析
数据评价
综合不同数据集的分析结果,评价申报产品是否在正常使用条件下,产品可达到预期性能;与预期受益相比较,产品的风险是否可接受。(完)