——关于征求医疗器械临床试验备案有关事宜意见的函
——食药监械管便函〔2015〕25号
从去年到今年陆陆续续有一些企业朋友总在咨询临床备案的相关事宜,诸如临床备案的流程、准备资料、伦理会前还是会后等问题,致众临床医学部门的小伙伴简明扼要的分享了一篇涵盖医疗器械临床试验备案有关事宜的文章,希望对朋友们有帮助~
医疗器械临床试验备案有关事宜
一、医疗器械临床试验开始前,申办者应当填写《临床试验备案表》,提交备案表中列出的相关材料,境内医疗器械向申办者所在地省级食品药品监督管理部门备案,进口医疗器械向代理人所在地省级食品药品监督管理部门备案。
二、接受备案的省级食品药品监督管理部门,对《临床试验备案表》填写完整且提交材料齐全的,应当当场备案。
三、接受备案的省级食品药品监督管理部门,应当在10个工作日内将备案信息通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。
四、备案信息有变化的,申办者应当在10个工作日内书面告知原备案管理部门。
五、 接受备案的省级食品药品监督管理部门应当每月10日前将备案信息以电子邮件方式报送国家食品药品监督管理总局医疗器械注册管理司。
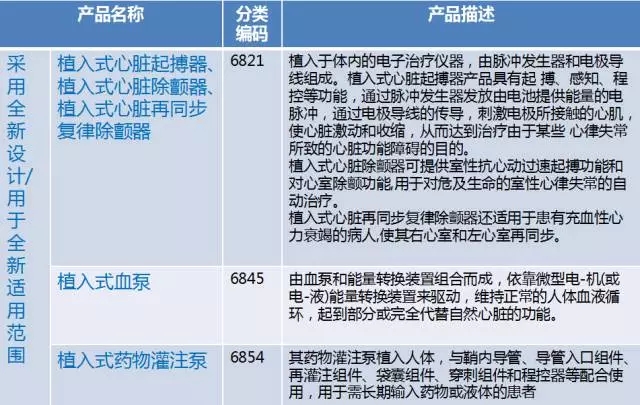
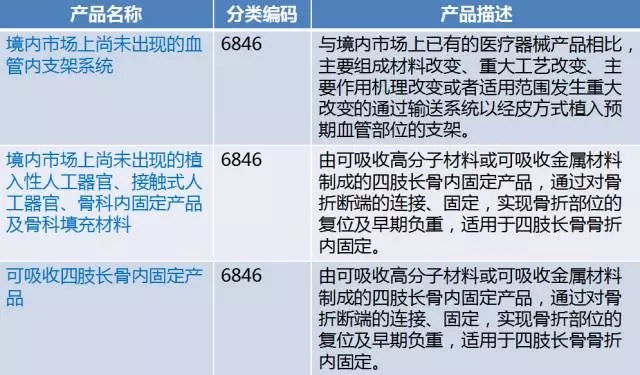
第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。
临床试验对人体具有较高风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。(《条例》第十九条 )
临床试验审批
临床试验审批是指国家食品药品监督管理总局根据申请人的申请,对拟开展临床试验的医疗器械的风险程度、临床试验方案、临床受益与风险对比分析报告等进行综合分析,以决定是否同意开展临床试验的过程。(《办法》第二十五条)
对于列入《需进行临床试验审批的第三类医疗器械目录》中的医疗器械应当在中国境内进行临床试验。
临床试验审批的流程和时限
总局自受理申请之日起3 个工作日内将申报资料转交技术审评机构;技术审评机构在40 个工作日内完成技术审评;总局在技术审评结束后20 个工作日内作出决定(准予开展/不予批准);
发出补充资料通知:技术审评机构一次告知需要补正的全部内容,申请人在1 年内按照补正通知的要求一次提供补充资料。技术审评几首自收到补充资料之日起40 个工作日内完成技术审评。
医疗器械临床试验应当在批准后3 年内实施;逾期未实施的,原批准文件自行废止,仍需进行临床试验的,应当重新申请。