(建议在WIFI情况下观看)
日前,FDA驻华办专门约见我会,就如何帮助中国企业了解政策最新变化和要求进行了讨论。3月22日,由医保商会和美国FDA驻华办公室共同主办的“美国FDA医疗器械UDI规程专题研讨会”在北京举办,来自中国国家食品药品监督管理总局和出口美国的医疗器械企业代表参加了研讨会。本次会议为监管机构和产业提供了很好的面对面交流的机会。现将现场视频及PPT发布在此,业界同仁可参照视频及PPT深入了解相关情况。
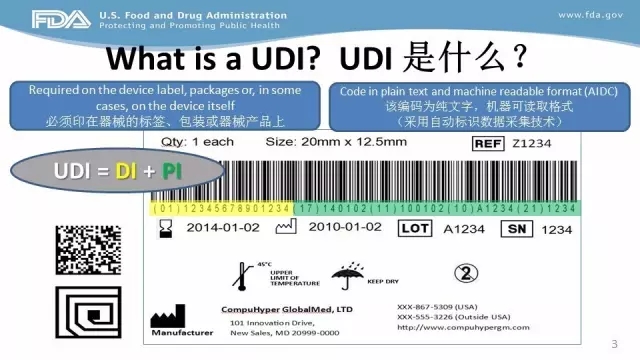
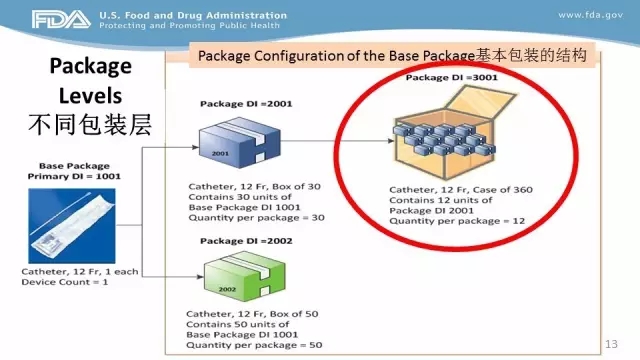
根据要求,输美II类医疗器械须在2016年9月24日之前完成网上UDI登记系统,有关准备工作包括研究UDI网站上的相关内容、选择UDI签发机构并将UDI加印在医疗器械上、选择主要的数据提交方式、对数据进行收集、了解GUDID账户的结构、找到/获取邓氏码、获取GUDID账户、提交器械标识数据、订阅GUDID系统邮件及时获知申请状态等工作。
企业如果在操作过程中遇到具体问题,欢迎随时联系商会。
联系人:陈婧婧: md@cccmhpie.org.cn



































【来源】中国医药保健品进出口商会
【整理】TACRO