【版权声明】本文已获原作者授权推送,版权归医疗器械从业者(ID:gh_afe271de26be)所有,如需转载,可联系医疗器械从业者授权白名单,谢谢。
【原创】你所不知道变更注册的那些事(上)【续上文】
PartB 技术或性能变更
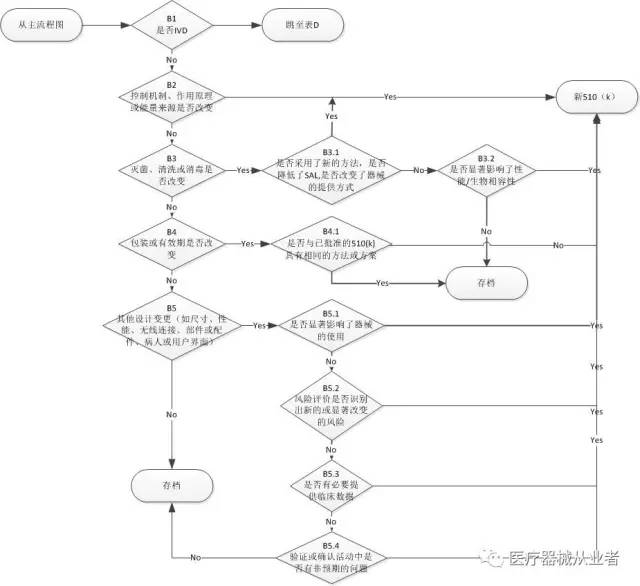
B1.是否是IVD,如是,跳至表D
B2. 控制机理,作用原理或能量来源是否改变
什么是控制机理的改变?
控制机理即器械的作用方式。如:
i. 微处理器控制代替电子机械控制;
ii. 数字信号代替模拟信号
什么是操作原理的改变?
器械达到其预期用途的操作模式或作用机理的改变。如:
i. 将计算机断层摄影X射线系统中使用的图像重建算法从简单的背投影改变为新的,更具辐射效率的方法。
什么是能量来源的改变?
能量输入或输出类型的改变。如:
i. 从发射微波能量到射频(RF)能量的变化。
ii.从AC到电池的变化。
B3. 灭菌、清洗或消毒是否改变
B3.1 是否采用了新的方法,是否降低了SAL,是否改变了器械的提供方式
i. 灭菌方法改变
EO灭菌变更为辐照灭菌
ii. 降低了灭菌保障水平SAL
通常不应低于10的负六次方
iii. 器械的提供方式
1) 一个病人,一次使用
2) 一个病人,多次使用
3) 多个病人,多次使用
B3.2 是否显著影响了性能/生物相容性
灭菌、消毒和清洗通常通过会对高分子材料、表面涂层产生影响。如:
1) 环氧乙烷灭菌会增加器械表面环氧乙烷的残留。
2) 清洗过程可能会引入对人体有危险的化学物质。
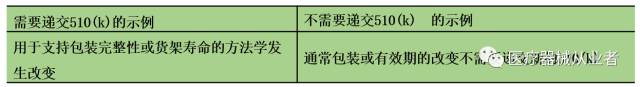
B4 包装或有效期是否改变
B4.1 是否与已批准的510(k)具有相同的方法或方案
B5 其他设计变更(如尺寸、性能、无线连接、部件或配件、病人或用户界面)
i. 尺寸变更
1) 应同时考虑尺寸和尺寸的重要性。如:
内窥镜工作通道直径1mm的改变比长度1mm的改变更有可能显著影响器械的安全性和有效性。
2) 如果尺寸变更在原批准范围内,则不需要递交新的510(k)。如:
原被批准器械的直径包括2mm和4mm,拟增加3mm直径,则不需要递交新的510(k)。
ii. 性能变更
通过B5.1-B5.4评价是否影响器械安全性和有效性。
iii. 部件或配件变更
部件或配件的变更很有可能影响其他部件或配件的使用,或导致不一样的使用方式。制造商还应该考虑部件或配件的变更既有可能影响器械的兼容性。
见B5.1-B5.4。
iv. 无线通信方式变更
器械组件之间或与其他产品之间的通信,特别是有线变更为无线,可能会改变器械的风险。见B5.1-B5.4。
v. 用户界面/接口的人为因素变更
制造商应通过B5.1-B5.4的途径评价用户界面/接口的变更是否会显著影响器械的安全性和有效性。但值得注意的是,仅仅为了增加爱用户或病人舒适度的变更通常不需要递交新的510(k)。
B5.1 是否显著影响了器械的使用
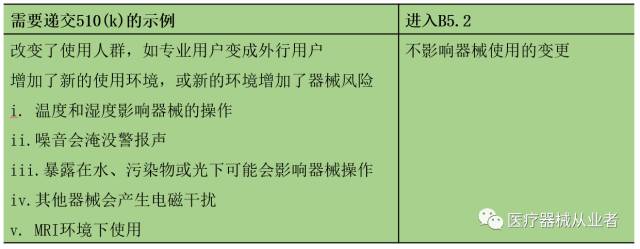
B5.2 风险评价是否识别出新的或显著改变的风险
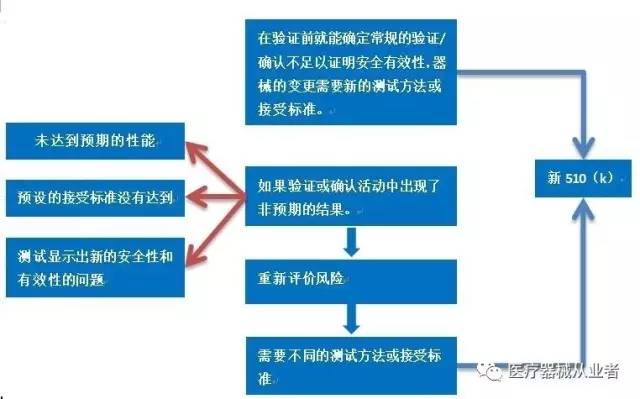
新的风险以及改变了已识别风险的可接受水平,或改变了对器械安全性和有效性极其重要的特征,需要提交新的510(k)。
制造商应识别,一种设计特征的改变是否影响另一种特征的改变,如器械尺寸或组件的变更,是否会影响再处理能力,或电子器械的温控能力。
B5.3 是否有必要提供临床数据
当台架试验或模拟使用不足以证明变更对安全性和有效性的影响时,应提交新的510(k)。
临床数据指的是用于设计确认的数据,不包括用户偏好测试。
B5.4 验证或确认活动中是否出现非预期的问题
PartC 材料变更
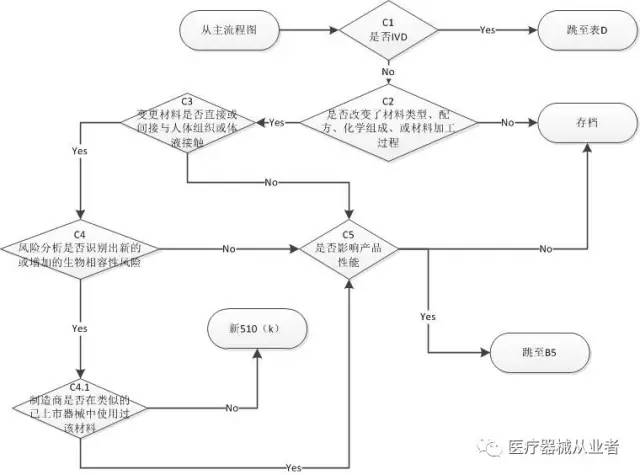
C1. 是否是IVD,如是,跳至表D
C2 是否改变了材料类型、配方、化学组成、或材料加工过程
C3 变更材料是否直接或间接与人体组织或体液接触
C4 风险分析是否识别出新的或增加的生物相容性风险

如果从供应商处拿不到具体的化学成分,则需要做化学成分分析或化学表征,以支持毒理学分析。如果分析结果显示存在新的化学物质或具有潜在的生物相容性风险,比如遗传毒性,则需要递交新的510(k)。
C4.1 制造商是否在类似的已上市器械中使用过相同的材料
i. 相同的材料:
1) 相同的配方或化学成分
2) 相同的工艺,包括灭菌
3) 基于成品,而非原材料
ii. 已上市器械:
1) 被FDA批准的器械
2) 制造商自己的已上市器械
iii. 类似的器械:
已上市的器械具有相同的或更危险的接触方式,相同的或更长的接触时间。
C5 是否影响产品性能
制造商应考虑该材料变更是否会影响器械的性能,如强度、硬度等。还应考虑新的材料是否会受清洗、消毒或灭菌过程的影响。
如果答案为“是”,跳到B5 进行评价。
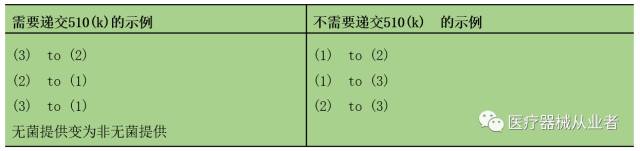
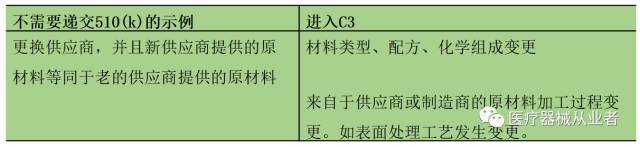
材料变更示例:

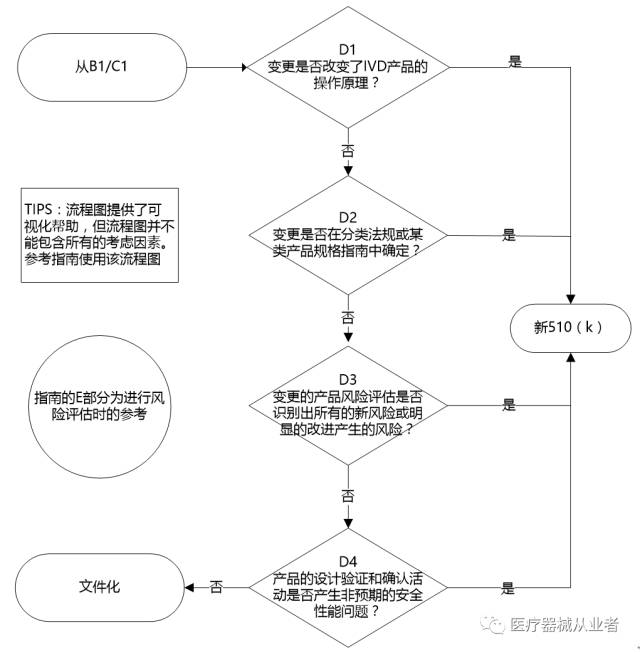
PartD IVD产品的技术、工艺、性能和材料的变更
来源:医疗器械从业者
整理:TACRO
【声明】部分文章和信息来源于互联网,不代表本订阅号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系(杨 13260664005),我们将迅速采取适当措施