来源: 本文刊登于《中国医疗器械信息》杂志2015年第12期11-17页
作者: 陈福军1 李非1 金丹1 袁鹏2 邓刚2
单位:1 辽宁省药械审评与监测中心 (沈阳 110003)
2 国家食品药品监督管理总局 (北京 100053)
内容提要: 目的:分析我国已颁布的医疗器械注册技术指导原则的现状,为医疗器械注册技术指导原则制修订工作提供参考和借鉴。方法:对我国已颁布的医疗器械注册技术指导原则进行分类归纳,并结合2010 至2015 年注册产品申报情况分析研究,通过数据对比找出分布情况和现状等。结果与结论:应进一步加快医疗器械注册技术指导原则制修订工作,加大医疗器械注册技术指导原则的基础研究力度,解决医疗器械注册技术指导原则的分布不均及缺失现状,以更好的服务于医疗器械的审评、审批和监管工作。
关 键 词:医疗器械 医疗器械注册技术指导原则 医疗器械注册技术指导原则分类 建议
随着医疗器械的广泛应用,其安全性和有效性受到公众的高度关注,医疗器械注册的注册检验、临床试验、质量体系核查、注册审查是其进入市场的必经之路,也是监管中至关重要的环节。医疗器械注册技术指导原则(以下简称“指导原则”)是代表监管机构对政策和问题的现行理解,是指导医疗器械注册申请人进行注册申报和开展医疗器械注册技术审评工作的规范性文件,亦是指导审评部门开展工作的宝贵资料和重要依据,是规范企业开发、生产、销售,产品和编写申报资料的重要根据,也是公众了解医疗器械产品信息的重要途径。指导原则结构的合理性和完整性对医疗器械上市前注册申报的质量有着重要作用,同时更会提高技术审评工作的效率,为注册申请人提供更高效的审评服务。因此,了解我国医疗器械注册技术指导原则的现状,对于提高我国医疗器械注册审评工作质量与效率、统一审评尺度、规范和指导注册申请人注册申报具有非常重要的意义。
基于技术指导原则的制修订要与实际工作需求相符的思路, 本文尝试通过产品分类编码,对指导原则在《医疗器械分类目录》 (国药监械[2002] 302 号)[1] 中各大类产品的覆盖情况进行分析来研究我国医疗指导原则现状,同时结合当前我国医疗器械注册产品中各大类医疗器械专业分布情况,提出指导原则制定的思路和下一步的工作建议。
1.1 指导原则在我国医疗器械注册审评技术规范的中的占比及其特点
截至2011 年年底我国医疗器械注册审评技术规范组成中的国家标准、行业标准和指导原则之间的比例大体为3:14:1[2],虽同属医疗器械注册审评技术规范范畴,但指导原则占比最低,只有5.6%,数量为64 项。依据国家食品药品监督管理总局公布最新数据,截止到2015 年8 月5 号,国家食品药品监督管理总局发布的医疗器械注册技术指导原则共118 项[3],较2011 年的64 项有了较大增长。自2007 年到2015 年8 月,每年指导原则发布情况[3] 见图1。
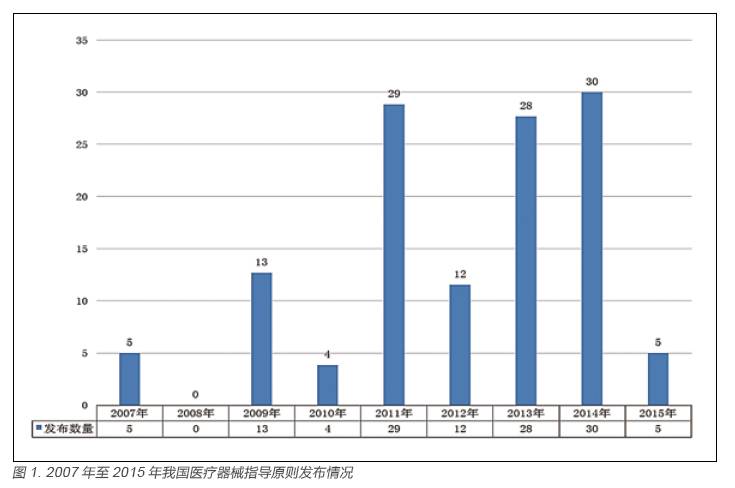
由图1 可知, 自2007 年到2014 年共发布指导原则126 项(含修订),平均每年约15 项。2015 年截止到8 月份虽然只有5 项指导原则发布,但随着指导原则相关课题的开展,以及制修订工作力度的加大和此项工作的逐渐重视,后续将会有多项指导原则发布。
较之于医疗器械标的国家标准、行业标准系由国家食品药品监督管理总局医疗器械标准管理中心统一组织全国22 个医疗器械专业标准化技术委员会进行制修订,并分别由国家标准化管理委员会或国家食品药品监督管理总局发布实施,指导原则是由各省级或国家级注册管理相关部门起草、国家食品药品监督管理总局发布后实施[4]。较于标准的使用主体范围,指导原则相对较窄,指导原则的使用主体则主要限于各省级和国家级医疗器械注册审评部门和医疗器械产品注册申报企业。标准主要规范的内容侧重于产品的安全、性能指标要求、检测方法和检验规则,或是产品的基础通用要求如医用电气安全和生物相容性要求等,指导原则的内容更多是针对具体产品的结构组成、适用标准、预期用途、主要技术指标、检测、临床要求、说明书、标签、包装和标识等方面的规定,主要适用于注册申报。与强制性医疗器械国家标准、行业标准不同,指导原则不作为强制性要求执行[5],类似推荐性医疗器械国家标准、行业标准。
1.2 覆盖情况分析
1.2.1 医疗器械分类编码系
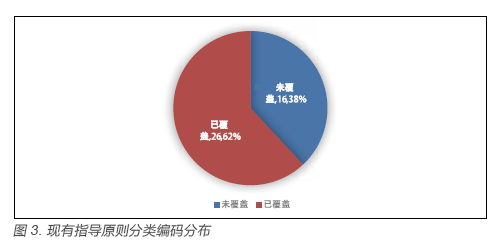
国家食品药品监督管理总局根据医疗器械产品种类特点编制的以“68”为前二位数字的医疗器械系列产品编码。2002 年原国家药品监督管理局发布的《医疗器械分类目录》采用了该系列的编码,并将医疗器械产品分为43 大类和260 小类[6]。据《医疗器械分类目录》中各医疗器械产品分类及其编码情况,对上述118 项医疗器械注册技术指导原则进行了产品分类,即产品覆盖面的分析。结果显示,除了《医疗器械临床评价技术指导原则》该基础性通用指导原则无法划归至某一大类医疗器械之外,其他共计117 项指导原则均可归类至医疗器械某一大类如6870(软件)大类或某一小类如6840(肌酸激酶测定试剂盒产品)产品。详见图2 及图3。
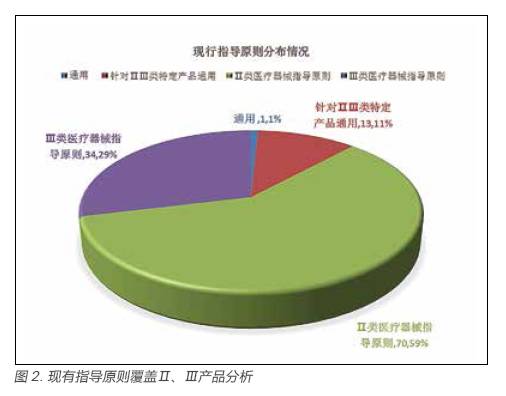
由图2(现有指导原则覆盖Ⅱ、Ⅲ产品分析)可知,基础性通用指导原则1 项(该指导原则为《医疗器械临床评价技术指导原则》),占比约为1% ;针对Ⅱ类或Ⅲ类某一特定产品(43 大类)通用指导原则13 项(《无源植入性医疗器械产品注册申报资料指导原则》、《动物源性医疗器械产品注册申报资料指导原则》、《一次性使用输注器具产品注册技术审查指导原则》、《酶联免疫法检测试剂注册技术审查指导原则》、《发光免疫类检测试剂注册技术审查指导原则》、《核酸扩增法检测试剂注册技术审查指导原则》、《金标类检测试剂注册技术审查指导原则》、《生物芯片类检测试剂注册技术审查指导原则》、《病原体特异性M 型免疫球蛋白定性检测试剂注册技术审查指导原则》、《流式细胞仪配套用检测试剂注册技术审查指导原则》、《体外诊断试剂临床试验技术指导原则》、《体外诊断试剂说明书编写指导原则》、《 医疗器械软件注册技术审查指导原则》),占比约为11% ;Ⅲ类指导原则34 项,占比约为29% ;Ⅱ类指导原则 70 项,占比约为 59%。由上图可知,相较于Ⅱ类指导原则无论从指导原则数量,还是占比,风险性较高的Ⅲ类医疗器械产品的指导原则均较少,但Ⅲ类产品及进口Ⅱ类产品均由国家食品药品监督管理总局医疗器械技术审评中心审评的审评模式减少了审评过程中审评尺度不统一等弊端。
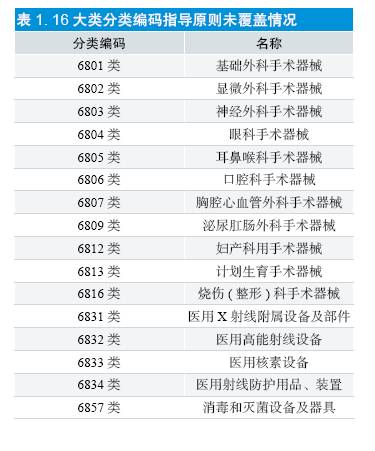
由图3(现有指导原则分类编码分布情况)可知,虽然现行指导原则的绝对数量相较于2011年在数量上有了很大提高,但43 大类产品中仍有16 大类,约38% 仍未有任何指导原则所覆盖。16 大类未覆盖产品见表1。对于26 大类产品已覆盖情况见图4。
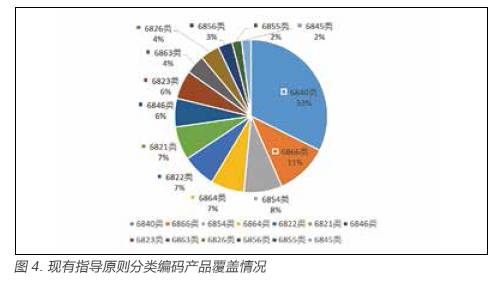
由图4(现有指导原则分类编码产品覆盖情况)可知,在上述117 项现有指导原则可归类至医疗器械各“68”系列分类编码的指导原则中,可归类至编码为6840(临床检验分析仪器)、6846(植入材料和人工器官)、6866(医用高分子材料及制品)、6822(医用光学器具、仪器及内窥镜设备)、6815(注射穿刺器械)、6877(介入器材)、6854(手术室、急救室、诊疗室设备及器具)、6863(口腔科材料)、6821(医用电子仪器设备)、6845(体外循环及血液处理设备)及6823(医用超声仪器及有关设备)、6826(物理治疗及康复设备)、6856(病房护理设备及器具)、6855(口腔科设备及器具)、6845(体外循环及血液处理设备)的指导原则数量为99 项,占据了前十三位,系所有医疗器械指导原则数量(117)的84%,前十三位占比情况见图4。具体数量,见图5。
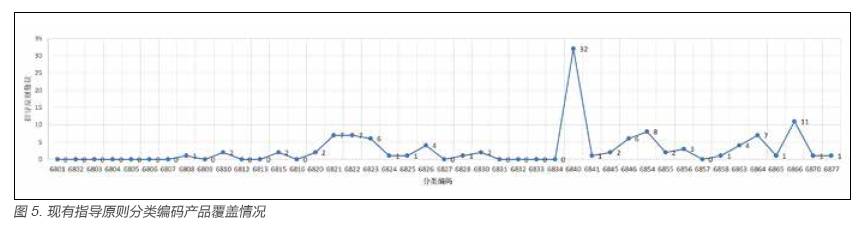
由图5 可知,6840(临床检验分析仪器)类指导原则最多,现行32 项、6846(植入材料和人工器官6846)类指导原则6 项、6866(医用高分子材料及制品)类指导原则11 项、6822(医用光学器具、仪器及内窥镜设备)类指导原则7 项、6864(介入器材)类指导原则7 项、6854(手术室、急救室、诊疗室设备及器具)类指导原则8项、6821(医用电子仪器设备)类指导原则7 项、6823(医用超声仪器及有关设备)类指导原则6 项。总体分布呈现相对集中的态势,个别大类只是停留在一至两项指导原则的状况,如6808 类(腹部外科手术器械)6824(医用激光仪器设备)等。
1.2.2 注册数量与现有指导原则匹配关系
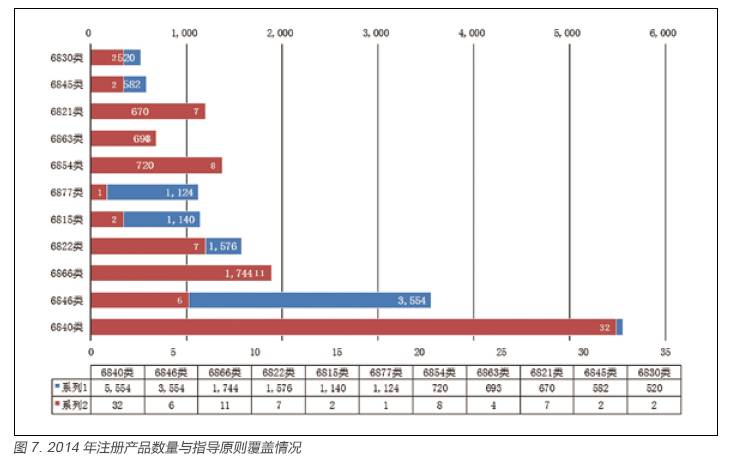
从上述数据可看出,指导原则的产品专业分布呈现出相对集中的特点,如6840 类(临床检验分析仪器)现有指导原则32 项,占已有指导原则的27%。虽然与产品申报数量相对具有一致性,对申报数量位于前11 位的产品有了一定的产品覆盖,见图6,但不同专业的指导原则修订发展仍不平衡。2014 年数据体现得尤为明显,见图7,如6815 类注册数量为1140 件,指导原则数量仅为2 项,6877 类注册数量为1124 项,指导原则数量仅有1 项。
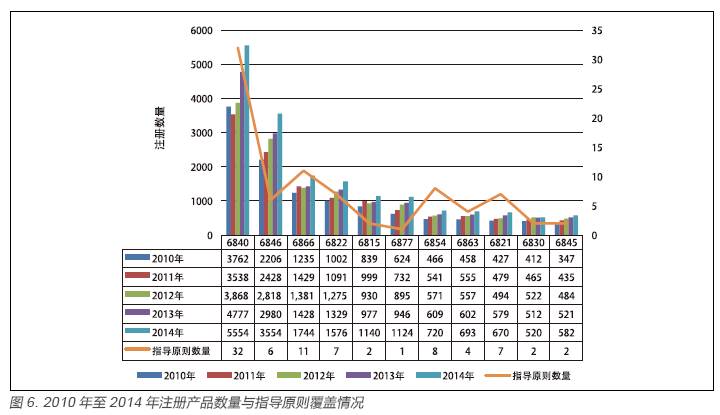
由图6 可知,自2010 年至2014 年,我国批准注册的医疗器械产品,注册数量占据前十一位的产品大类依次为6840 类、6846 类、6866类、6822 类、6815 类、6877 类、6854 类、6863类、6821 类、6830 类、6845 类。该十一类产品近五年来一直为注册数量最多产品,共计71792件。2010 年至2014 年我国批准注册的医疗器械产品共计81092 件,占比约为89%。与之相对应此十一类产品指导原则(82 项)占总指导原则(118项)的比例为69%。虽然指导原则数量与申报数量基本相适应,但详细分析后仍发现不协调的地方,如6815 类与6877 类指导原则数量相对过少,与注册数量不匹配。
此种情况在2014 年注册产品中体现得更为明显,如6815 类注册数量为1140 件,指导原则数量仅为2 项,6877 类注册数量为1124 项,指导原则数量仅为1 项,见图7。
指导原则主要使用主体为注册审评部门的审评人员,企业申报时作为参考。建立以产品上市和注册审评实际需求为导向的指导原则制修订工作机制,进一步梳理和细化当前医疗器械注册产品各专业种类分布,明确重点高风险以及量大面广亟需规范的产品种类,结合指导原则现状,加快开展此类产品指导原则的制修订工作。
因此,加强医疗器械指导原则的制修订工作,首先要解决三个问题:
2.1 解决分类编码中指导原则缺失问题
解决分类编码中指导原则缺失问题,即解决指导原则的产品覆盖面即广度的问题,至今仍有16 大类产品无指导原则覆盖的情况,约为40%的大类产品目前尚无指导原则覆盖,如:6833(医用核素设备)类的核素扫描仪及核素针式探测器等具体见表1. 在后续指导原则制修订工作中应及时弥补空白。
2.2 解决比例与增量不对称的分类问题
需重点加强对于一些指导原则自身数量稀少或缺失,而注册审评中又亟需规范、新近发展迅速的产品指导原则制定的研究工作,做好形式预估,转变观念,依据预期,有所准备,例如,随着医疗科技的发展软件在有形与无形之中对医疗器械的影响会表现得愈发明显,对6870(软件)指导原则的制修订工作应引起重视。如6870(软件)在注册审评中目前仅有1 项指导原则可以依据(《医疗器械软件注册技术审查指导原则》),而近几年增长较快的远程医疗产品及PACS 产品缺少必备的指导原则。
2.3 解决比例与存量不对称的分类问题
要解决指导原则的产品覆盖侧重点偏差问题,有针对性地开展对产品注册数量较多产品(例如上述统计结果排名前十一位的产品)的指导原则的制定工作,尤其是6846(植入材料和人工器官)产品如:人工髋关节、人工膝关节等,占注册产品数量的第二位,而其指导原则数量虽然在所有规范中排名第七,但仅为6 项,与植入材料和人工器官产品实际注册需求相差甚远。此种情况在2014 年注册产品中体现得更为明显,如6815 类注册数量为1140 件,指导原则数量仅为2项,6877 类注册数量为1124 项,指导原则数量仅为一项,见图7。应注意尽量避免一些产品注册数量不多,但其指导原则数量又相对过剩现象的发生,如6864(医用卫生材料及敷料)产品如:透明敷料、敷料贴等指导原则数量占指导原则的第四位,其注册数量却在十五位之后,统筹安排好指导原则制修订的有限力量和资源。具体指导原则产品覆盖与注册产品种类分布及排名情况见图6。
医疗器械指导原则体系可以以《医疗器械分类目录》(包括独立于分类目录自成一大类的体外诊断试剂产品)的分类情况为基本框架展开研究,结合产品注册申报和审批情况,编制切合注册监管实际、科学、合理的指导原则体系。另外,由于医疗器械产品种类繁多、数量巨大,仅2002 年医疗器械分类目录260 小类内列举的产品种类就将近1500 项,且尚有很多类产品包括占注册总量1/4 之多的体外诊断试剂产品目录亦未在分类目录之列。因此,须针对单一产品种类制定指导原则,并借鉴FDA 相关先进经验,通过对中美医疗器械指导原则的研究,为完善和发展我国医疗器械指导原则提供借鉴,并加大指导原则的制修订力度,及时发布与更新。
来源:中国医疗器械信息杂志
整理:TACRO
【声明】部分文章和信息来源于互联网,不代表本订阅号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系(杨 13260664005),我们将迅速采取适当措施