2017年11月14日,江苏省食品药品监督管理局发布一则《关于2017年医疗器械临床试验监督抽查工作情况的通告》,通告中公布了54个医疗器械临床试验项目将被抽查,并将于11-12月实施现场检查。
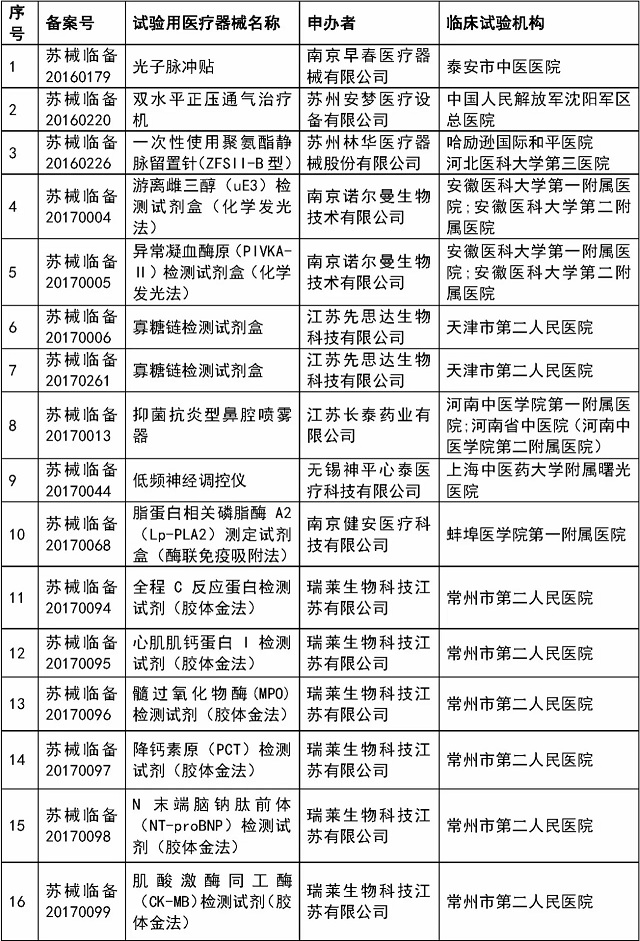
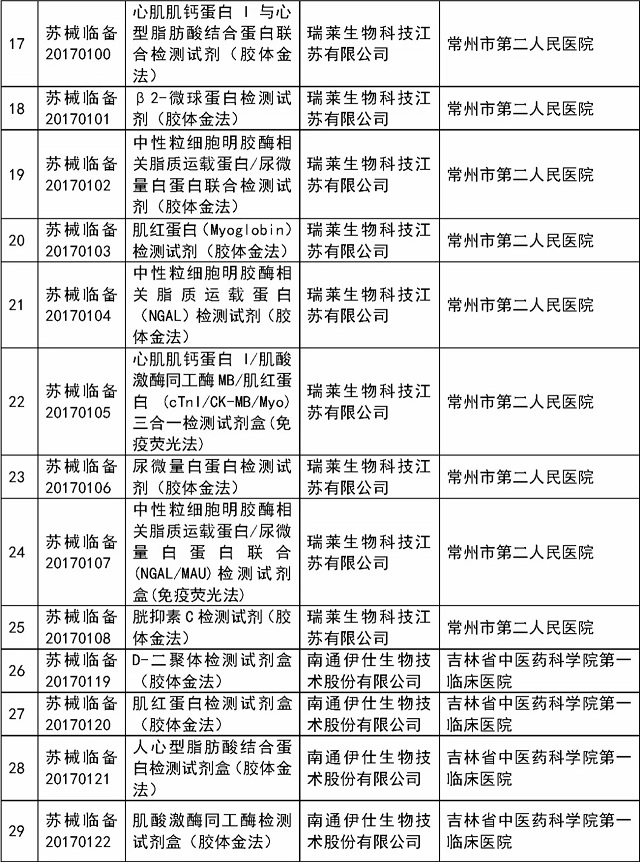
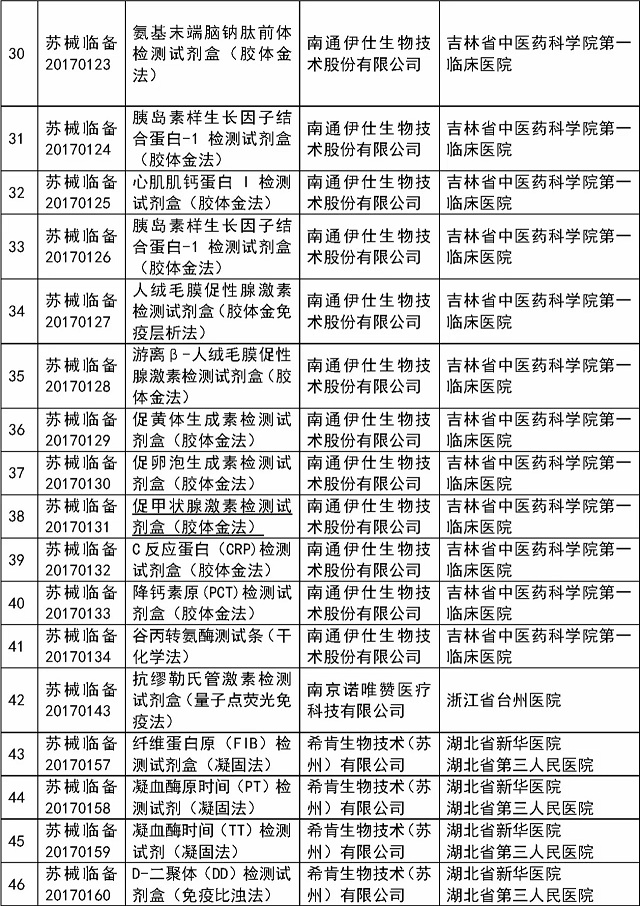
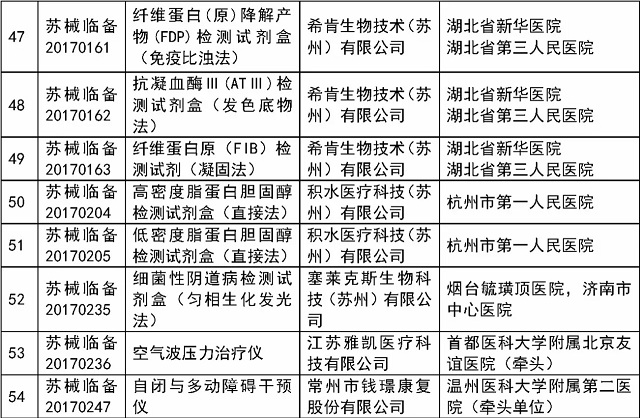
医疗器械临床试验监督抽查项目清单:
以下是通告原文:
为加强医疗器械临床试验监管,省食品药品监管局(以下简称“省局”)将抽取辖区内部分已备案的医疗器械临床试验进行临床试验数据真实性、合规性现场检查,规范医疗器械临床试验具体行为,强化申请人和临床试验机构的法律意识、责任意识和质量意识。现就有关事项通告如下:
一、监督抽查项目和时间
省局将于2017年11月~12月对已在省局备案过的医疗器械临床试验项目中抽取54个项目实施现场检查,包括本省首次审批产品、治疗类产品、体外诊断试剂等产品,具体项目名单见附件1。
二、现场检查依据和安排
本次检查主要依据《江苏省医疗器械临床试验现场检查要点》(附件2)要求,结合《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局 中华人民共和国国家卫生和计划生育委员会令第25号)相关规定,按照《江苏省医疗器械临床试验现场检查程序》(附件3)抽调江苏省医疗器械生产监督检查员组成检查组进行现场检查。注册申请人在接到检查组通知后,应通知相关的临床试验机构迎接检查。
三、结果判定
(一)有以下情形之一的判定为存在真实性问题:
1.注册申请提交的临床试验资料与临床试验机构保存的相应临床试验资料不一致的;
2.临床试验数据不能溯源的;
3.受试产品/试验用体外诊断试剂或试验用样本不真实的。
(二)未发现真实性问题,但临床试验过程不符合相关规定要求的,判定为存在合规性问题。
(三)未发现真实性和合规性问题的,判定为符合要求。
四、问题处置
在检查中发现临床试验数据存在真实性问题的,将根据《医疗器械注册管理办法》第三十九条、《体外诊断试剂注册管理办法》第四十九条,对已经申请产品注册的作出不予注册的决定,并按照《中华人民共和国行政许可法》第七十八条,对该注册申请自不予注册之日起一年内不予再次受理;仅存在合规性问题的,对注册申请资料和现场检查发现的问题进行安全性和有效性综合评价,作出是否批准注册的决定;对于还在进行中的临床实验发现的问题,企业和试验机构应对相关问题进行彻底整改,必要时可以暂停临床试验的进程。
对监督抽查中发现临床试验数据真实性问题的申请人,省局适时对其既往已经注册产品的临床试验数据进行回顾性检查,发现虚假材料的根据《中华人民共和国行政许可法》第七十九条、八十条相关规定进行处罚。
附件:1.江苏省2017年医疗器械临床试验监督抽查项目
2.江苏省医疗器械临床试验现场检查要点(2017)
3.江苏省医疗器械临床试验现场检查程序
江苏省食品药品监管局
2017年11月14日