(2019年第89号)
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家药品监督管理局组织对超声多普勒胎儿心率仪、腹部穿刺器等5个品种的产品进行了质量监督抽检,共28批(台)产品不符合标准规定。具体情况通告如下:
一、 被抽检项目不符合标准规定的医疗器械产品
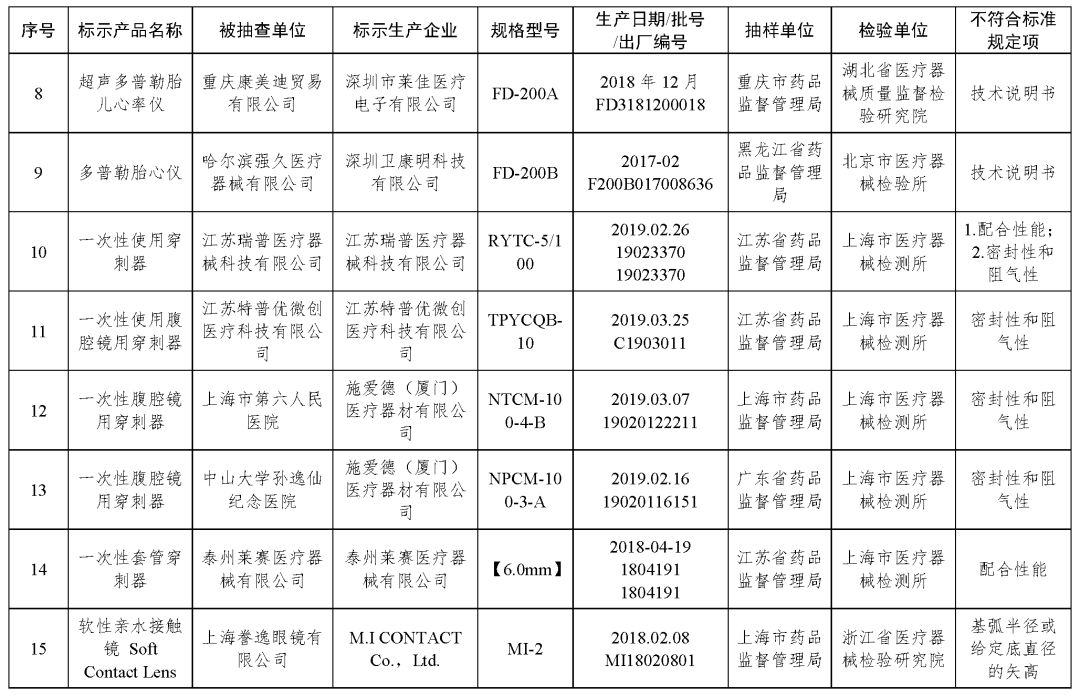
(一)超声多普勒胎儿心率仪9台产品:广州三瑞医疗器械有限公司、康铂创想(北京)科技有限公司、深圳市安保科技有限公司、深圳市安科瑞仪器有限公司、深圳市捷美瑞科技有限公司、深圳市莱佳医疗电子有限公司、深圳卫康明科技有限公司生产,涉及识别、标记和文件及技术说明书不符合标准规定。
(二)腹部穿刺器5批次产品:江苏瑞普医疗器械科技有限公司、江苏特普优微创医疗科技有限公司、施爱德(厦门)医疗器材有限公司、泰州莱赛医疗器械有限公司生产,涉及配合性能、密封性和阻气性不符合标准规定。
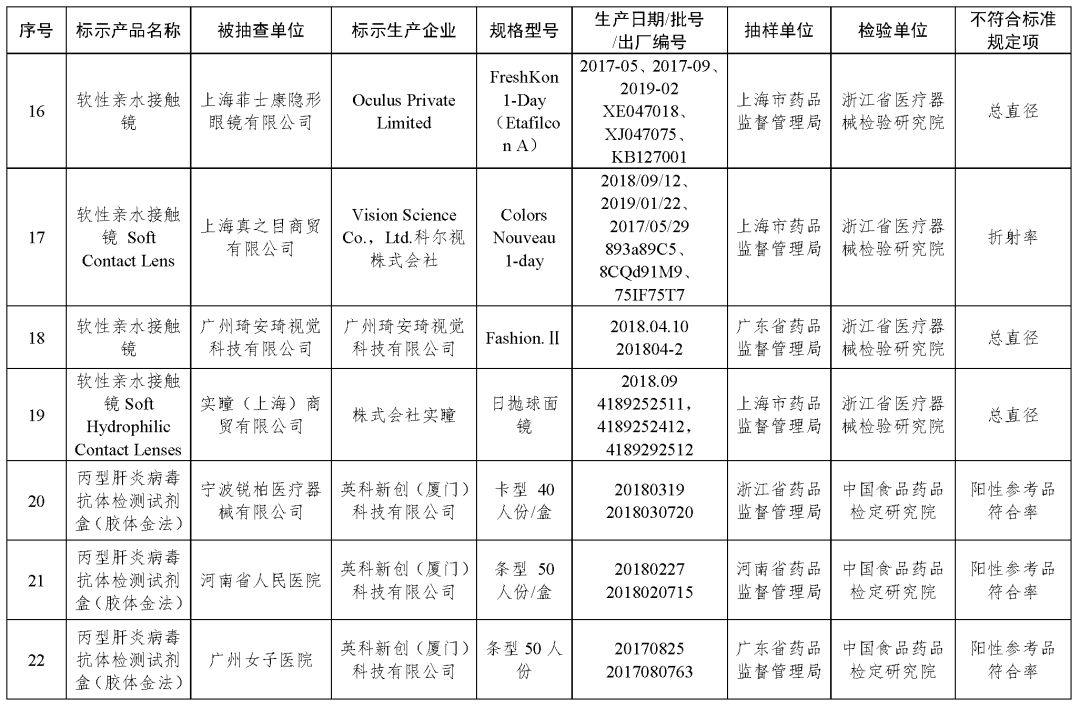
(三)软性接触镜5批次产品:M.I CONTACT Co.,Ltd.、Oculus Private Limited、Vision Science Co.,Ltd.科尔视株式会社、广州琦安琦视觉科技有限公司、株式会社实瞳生产,涉及基弧半径或给定底直径的矢高、总直径、折射率不符合标准规定。
(四)丙型肝炎病毒(HCV)抗体检测试剂盒(胶体金法)8批次产品:英科新创(厦门)科技有限公司生产,涉及阳性参考品符合率不符合标准规定。
(五)医用防护口罩1批次产品:江西3L医用制品集团股份有限公司生产,涉及密合性不符合标准规定。
以上抽检不符合标准规定产品具体情况见附件。
二、对上述抽检中发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械召回管理办法》等法规规章要求,及时作出行政处理决定并向社会公布。企业所在地省级药品监督管理部门要督促相关企业对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
特此通告。
附件:国家医疗器械抽检不符合标准规定产品名单
国家药监局
2019年11月29日