关于《医用磁共振成像系统临床评价技术指导原则》征求意见的通知
为了规范医用磁共振成像系统的临床评价资料要求,提高技术审评工作的质量和效率,我中心组织起草了《医用磁共振成像系统临床评价技术指导原则》征求意见稿(附件1),即日起在网上公开征求意见。
衷心希望相关领域的专家、学者和从业人员提出意见和建议。如有意见或建议,请填写反馈意见表(附件2),并将该表以电子邮件形式于2016年10月30日前反馈至我中心审评一部。
联系人:杨鹏飞
电话:010-68390619
电子邮箱:yangpf@cmde.org.cn
附件:1.《医用磁共振成像系统临床评价技术指导原则》(征求意见稿)
2.反馈意见表
国家食品药品监督管理总局
医疗器械技术审评中心
2016年10月9日
附件一
医用磁共振成像系统临床评价技术指导原则
(征求意见稿)
一、前言
本指导原则是对医用磁共振成像系统临床评价的一般要求,注册申请人应依据具体产品的特性对医用磁共振成像系统临床评价的内容进行充实和细化。注册申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围
本指导原则适用于医用磁共振成像系统注册申报时的临床评价工作。
三、临床评价要求
(一)同品种医用磁共振成像系统
同品种磁共振成像系统,是指与拟申报产品预期用途相同,磁体类型和场强相同,在基本原理,结构组成、生产工艺、与人体接触部分的制造材料、性能要求、安全性评价、软件核心功能、符合的国家/行业标准等方面基本等同,且已在中国境内合法上市的医用磁共振成像系统。
若拟申报产品与对比产品存在表1的差异,则拟申报产品与对比产品不属于同品种产品。
|
1 |
如磁共振设备静磁场产生方式(永磁型、常导型、超导型)不同。 |
|
2 |
拟申报产品较对比产品生产工艺差别较大,产品质量和稳定性没有充分的证据进行评价。 如磁体制造商不同,所采用的生产工艺无法进行比较或生产工艺的差异没有充分的证据进行评价。 |
|
3 |
如静磁场场强(0.35T、1.5T、3.0T)不同; 如系统支持的共振原子核(1H、19F、23Na、13C等)不同。 |
|
4 |
|
|
5 |
拟申报产品较对比产品适用范围不同。 如应用部位(四肢、全身)不同。 |
2.同品种医用磁共振成像系统组件定义
同品种磁共振成像系统组件,是指与拟申报磁共振成像系统中组件在基本原理、结构组成、与人体接触部分的制造材料、生产工艺、性能要求、安全性评价、软件核心功能、符合的国家/行业标准、预期用途等方面基本等同的组件。
拟申报产品组件与对比组件存在表2的差异,则拟申报产品与对比产品属于同品种组件。
|
1 |
拟申报产品组件较对比组件结构设计基本相同,不同之处并未对安全有效性产生不利影响。 如发射及接收通道数、液氦挥发量等。 |
|
2 |
拟申报产品组件较对比组件与人体表面接触部分材料不同,不同之处并未对安全有效性产生不利影响。 如线圈表面材料变化(聚碳酸酯、玻璃纤维等) |
若拟申报产品组件与对比组件存在表3的差异,则拟申报产品与对比产品不属于同品种组件。
表3 拟申报产品组件与对比组件的差异
|
1 |
如局部线圈类型(发射/接收线圈、发射线圈、接收线圈,容积线圈、表面线圈)不同 |
|
2 |
拟申报产品软件组件较对比软件组件核心软件功能、序列家族、对比度特性等发生重大变化 如新增平面回波序列家族 |
|
3 |
拟申报产品组件较对比组件的临床适用范围增加,在原有的基础上开发了新的临床应用领域。 如增加新的临床应用部位 |
注册申请人通过同品种医用磁共振成像系统临床试验或临床使用获得的数据进行分析评价,证明产品安全、有效的,需首先将拟申报产品与一个或多个同品种产品进行对比,证明二者之间基本等同。
与每一个同品种产品进行对比的项目均应包括但不限于附件1列举的项目,对比内容包括定性和定量数据、验证和确认结果,特别要注意备注中的内容,应详述二者的相同性和差异性,对差异性是否对产品的安全有效性产生不利影响,应通过拟申报产品自身的数据进行验证和/或确认,如拟申报产品的非临床研究数据、临床图像评估数据、临床文献数据、临床经验数据、针对差异性的临床试验的数据。临床试验应符合临床试验质量管理规范相关要求。
注册申请人应参考附件1提供对比信息。若存在不适用的项目,应说明不适用的理由。
4.同品种医用磁共振成像系统组件的判定
拟申报医用磁共振成像系统组件与对比组件是同品种组件的前提是:两者分别包含在拟申报医用磁共振成像系统及同品种医用磁共振成像系统中;或拟申报医用磁共振成像系统组件及对比组件可脱离系统独立评价。如某些后处理功能软件组件的应用与系统无关联或关联较小,可脱离系统独立评价,则两者为同品种组件。独立评价的医用磁共振成像系统组件在临床评价的过程中可仅考虑组件信息,如临床文献检索过程中可不检索系统信息,仅检索组件信息。
拟申报产品组件与对比组件若为同品种组件,则由该组件带来的拟申报产品与同品种产品的差异可通过拟申报产品的非临床研究资料、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据来验证;拟申报产品组件与对比组件若不为同品种组件,则由该组件带来的拟申报产品与同品种产品的差异需按照临床试验质量管理规范提交相应临床试验资料。
同品种医用磁共振成像系统组件的对比信息也可参照附件1中的适用对比内容。
(二)评价路径
拟申报产品与对比产品关系有两种,或为同品种产品,或非同品种产品,对应的评价路径及需提交资料类型简表如下:
表4 拟申报产品与对比产品关系简表
|
拟申报产品与对比产品关系 |
拟申报系统与对比系统差异类型 |
具体评价路径 |
需提交资料类型 |
|
为同品种
|
存在差异,但差异未产生不利影响 |
评价路径1 |
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据 |
|
存在差异,但差异产生不利影响 |
评价路径2 |
针对差异的临床试验资料 |
|
|
非同品种 |
|
评价路径3 |
针对系统的临床试验资料 |
若拟申报产品与对比产品属于同品种产品,且两者的差异可通过拟申报产品的非临床研究资料、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据来验证,如表2情况,则具体评价路径见附件2 评价路径1。
若拟申报产品与对比产品属于同品种产品,且两者的差异不能通过拟申报产品的非临床研究资料、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据来验证,只能通过相应的临床试验资料来验证,如表3情况,则具体评价路径见附2 评价路径2。
若拟申报产品与对比产品不属于同品种产品,如表1情况,则具体评价路径见附件2 评价路径3。
(三)证明拟申报产品与同品种医用磁共振成像系统的差异对产品的安全有效性未产生不利影响的支持性资料(非临床研究、临床图像评估数据、临床文献数据、临床经验数据等)
1.概述
支持性资料中应明确说明拟申报产品与同品种医用磁共振成像系统的差异;详细说明针对拟申报产品与同品种医用磁共振成像系统的差异进行的研究方式及研究结果,提供的研究证据应证明拟申报产品与同品种医用磁共振成像系统的差异对产品临床使用的安全性和有效性带来的收益/影响。拟申报产品与同品种磁共振成像系统常见主要差异示例见附件3,其中评估了不同单一差异对应的评价路径。
另外,应注意如下内容:
(1)应全面、完整地列出拟申报产品与同品种医用磁共振成像系统的所有差异点,并说明这些差异点的相互关系。若拟申报产品与同品种产品的多个差异点之间存在相关性/相互影响,则应提供针对单个差异点的影响的研究证据和针对这些差异点共存时的影响的研究证据。如通过变更磁体、梯度线圈和发射线圈的尺寸实现患者孔径从60cm增加到70cm,此时需要先提供证据证明磁体尺寸变化对磁体相关指标的影响,梯度线圈变更对梯度相关指标的影响,发射线圈变更对发射相关指标的影响;然后再说明这些因素共同作用时对最终临床有效性的影响。
(2)应根据拟申报产品与同品种医用磁共振成像系统的具体差异点提供相应的支持性资料,资料的类型和数量应根据拟申报产品和对比产品的差异点对系统安全性和有效性的影响进行制定。
(3)基于拟申报产品和同品种医用磁共振成像系统的对比结果,企业应对拟申报产品与对比产品的差异性及该差异对产品安全性和有效性的影响进行全面、深入地评估,如果非临床研究、临床图像评估数据、临床文献数据、临床经验数据等无法充分地证明该差异对产品安全性和有效性的影响,则应提供相应的临床试验证据。
根据拟申报产品与同品种产品的差异,分别列出针对各差异点所进行的非临床研究的内容和结果。
根据拟申报产品与对比产品的差异点的不同,注册申请人可提供制造商内部验证的或临床机构的针对差异性的临床图像评估资料。如有需要,可以提供拟申报产品临床图像评估资料,建议将同品种产品的临床图像与拟申报产品的临床图像在同样的或相似的条件下进行评估,如表4所示。
临床图像评估资料中若包含拟申报产品和对比产品的图像,所选择图像应覆盖拟申报产品与对比产品差异点影响的所有临床应用,并对拟申报产品和对比产品的图像进行对比评价,表5中的图像具体评价标准可参考《医用磁共振成像系统注册申报资料指导原则》中影像评估标准的相应内容。
提交的图像均应提供对应的扫描部位、关键扫描参数和扫描时间信息;提交的图像均应删除任何患者识别信息和医疗单位名称信息。提交的图像应由至少两位资深放射科临床诊断专家进行双盲评估,评估的结果应证明所有提交的图像满足临床诊断要求。资深放射科临床诊断专家的选择标准应符合如下三项要求:(1)三甲医院具有GCP资质临床影像专家;(2)具有磁共振诊断经验;(3)副主任医师及以上职称。
表5 拟申报产品临床图像对比表示例
|
部位 |
序列 |
拟申报产品 |
对比产品 |
具体评价标准 |
||
|
部位1 |
序列1 |
图像1 |
主要参数 |
图像2 |
主要参数 |
|
|
|
序列2 |
图像3 |
主要参数 |
图像4 |
主要参数 |
|
|
部位2 |
序列1 |
图像1 |
主要参数 |
图像2 |
主要参数 |
|
|
…… |
…… |
…… |
…… |
…… |
…… |
|
4. 针对差异性的临床文献数据收集和分析
根据拟申报产品与同品种产品的差异点,合理选择临床文献数据库,准确设置检索词,进行全面的科学文献检索,完成文献检索和筛选方案、文献检索和筛选报告。可参考《医疗器械临床评价技术指导原则》中相关内容。
5.针对差异性的临床经验数据的收集和分析
在综合考虑、科学分析拟申报产品与同品种磁共振产品差异的基础上,可提供临床经验数据收集内容,包括对已完成的临床研究、不良事件、与临床风险相关的纠正措施等数据的收集。可参考《医疗器械临床评价技术指导原则》中相关内容。
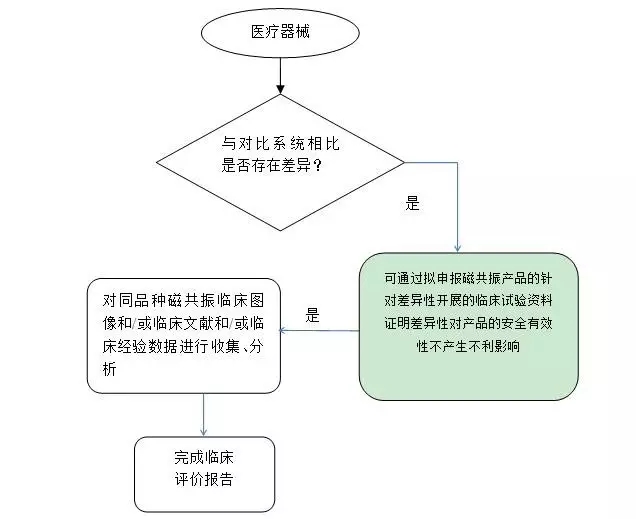
6. 针对差异性的临床试验资料(如有)
对于磁共振成像系统而言,拟申报产品与同品种产品通常存在的差异主要如附件3所列。当这些差异无法通过非临床研究资料、和/或临床图像评价数据、和/或临床文献数据、和/或临床经验数据来证明拟申报产品的安全性和有效性,则需按照规定提交相应临床试验资料。
数据集的建立、统计分析及质量评价可参考《医疗器械临床评价技术指导原则》中相关内容。
同品种医疗器械临床数据收集、分析评价可参考《医疗器械临床评价技术指导原则》中相关内容。
(五)临床评价报告
临床评价完成后需撰写临床评价报告(格式见附件4),在注册申请时作为临床评价资料提交。
四、临床试验相关要求
对于在中国境内进行临床试验的医用磁共振成像系统,其临床试验应按照医疗器械临床试验质量管理规范的要求开展。注册申请人在注册申报时,应当提交临床试验方案和临床试验报告。临床试验的设计可参考《医用磁共振成像系统注册申报资料指导原则》。
五、参考文献
略
附件:1.拟申报产品与同品种产品对比表
2.评价路径
3.拟申报产品与同品种产品常见差异
4.通过同品种产品临床试验或临床使用获得的数据进行的分析评价报告
附件1:拟申报产品与同品种产品对比表
(拟申报组件与同品种医用磁共振成像系统组件的对比表)
|
序号 |
对比项目 |
同品种产品 |
拟申报产品 |
差异性 |
支持性资料概述 |
备注 |
|
1 |
基本原理 |
|||||
|
1.1 |
工作原理 |
|
|
|
|
自旋原子核可能为1H、19F、23Na、13C、17O、31P等其中一种,拟申报产品和同品种产品自旋原子核必须相同; |
|
1.2 |
作用机理 |
|
|
|
|
|
|
2 |
结构组成 |
|||||
|
2.1 |
产品组成 |
|
|
|
|
依据拟申报的产品组成对比。 |
|
2.2 |
核心部件 |
|
|
|
|
核心部件的对比信息描述可参照《医用磁共振成像系统注册技术审查指导原则》附录I进行。 |
|
3 |
生产工艺 |
|
|
|
|
对比磁体生产工艺、梯度子系统生产工艺、射频子系统生产工艺、谱仪(若有)生产部件工艺以及系统集成生产工艺流程应一致,重点关注特殊工艺和关键工艺的对比。 |
|
4 |
与人体接触部分的制造材料 |
|
|
|
|
对制造材料的生物相容性进行评价。 |
|
5 |
性能要求 |
|||||
|
5.1 |
性能参数 |
|
|
|
|
依据附件3所定义的部件差异列举相关功能参数的对比表,相应差异应在不影响安全性和有效性的允许范围内。 |
|
5.2 |
功能参数 |
|
|
|
|
|
|
6 |
安全性评价 |
|||||
|
6.1 |
生物相容性 |
|
|
|
|
|
|
6.2 |
通用电气安全 |
|
|
|
|
|
|
6.3 |
专用安全 |
|
|
|
|
|
|
6.4 |
辐射安全(包括激光装置) |
|
|
|
|
|
|
6.5 |
电磁兼容安全 |
|
|
|
|
|
|
7 |
软件核心功能 |
|
|
|
|
需至少包括:系统扫描功能、数据管理功能、图像处理及患者档案管理。 在图像处理功能中,要重点关注是否新增多平面重建、最大/最小密度投影等图像后处理功能及图像重建功能。 |
|
8 |
产品符合的国家/行业标准 |
|
|
|
|
|
|
9 |
适用范围 |
|||||
|
9.1 |
适用人群 |
|
|
|
|
适用人群变更,如新增老年人、儿童、婴幼儿、妊娠女性等特殊人群 |
|
9.2 |
适用部位 |
|
|
|
|
适用部位的变更,如增加新的适用部位、改变特定适用部位的扫描方式(如接收线圈改变)等 |
|
9.3 |
与人体接触方式 |
|
|
|
|
|
|
9.4 |
适应症 |
|
|
|
|
|
|
9.5 |
使用环境 |
|
|
|
|
|
|
10 |
禁忌症 |
|
|
|
|
|
|
11 |
防范措施和警告 |
|
|
|
|
|
|
12 |
灭菌/消毒方式 |
|
|
|
|
|
|
13 |
产品说明书 |
|
|
|
|
|
附件2 医用磁共振成像系统评价路径
通常医用磁共振成像系统临床评价包括如下三条路径:
1.若拟申报产品与对比产品属于同品种产品,且两者的差异可通过拟申报产品的非临床研究资料、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据来验证,则具体评价路径见下评价路径1。
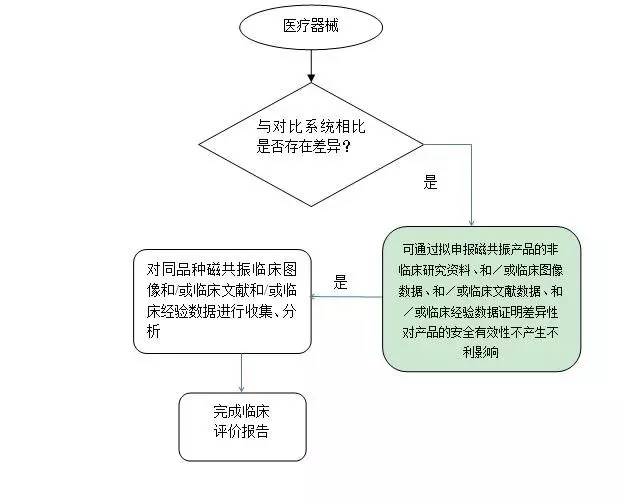
评价路径1
2.若拟申报产品与对比产品属于同品种产品,且两者的差异不能通过拟申报产品的非临床研究资料、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据来验证,只能通过相应临床试验资料来验证,则具体评价路径见下评价路径2。
评价路径2
3.若拟申报产品与对比产品不属于同品种产品,则具体评价路径下评价路径3。
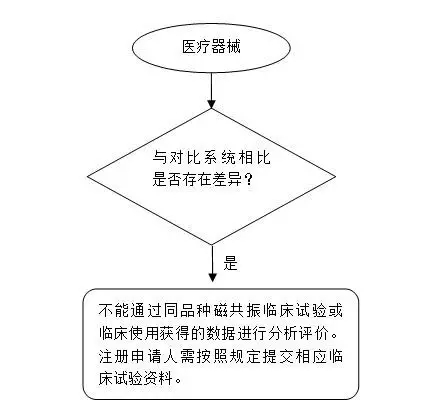
评价路径3
附件3 拟申报产品与同品种磁共振成像系统常见主要差异示例
(下表仅体现单一差异对应的评价路径)
部件名称
指标
常见选项
是否同品种产品或组件
理由/对比内容
评价路径
主磁体
制造商
不同制造商生产的磁体
否
磁体制造工艺繁复,不同制造商生产的磁体存在一定工艺差异不是同品种产品。
3
场强
0.35T,1.5T,3T等
否
(1)场强不同导致磁体的设计和生产工艺都会有差异。
(2)不同场强下,介质共振不同,图像信噪比、均匀性不同。
3
安装的类型
固定、移动或便携式
是
1
主磁体外壳材料
不锈钢、铝合金
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
主磁体类型
超导、电磁、永磁
否
磁场分布模式不同,需要进行临床试验才能确定有效性。
3
匀场方法
主动匀场、被动匀场
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
高阶匀场线圈(如适用)
A20匀场、5通道二阶匀场等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
屏蔽方式
主动屏蔽
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
制冷剂类型(如适用)
液氦、液氮
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
蒸发损耗率(如适用)
零液氦挥发、X 升/天
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
磁场时间的稳定性
X ppm/小时
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
磁场空间的均匀性(同时申明匀场区的大小)
500mmDSV Xppm(vrms)
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
磁体的患者空间几何尺寸
60cm、65cm、70cm
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
散逸场的范围(5高斯线的位置)
距磁体几何中心径向、轴向X米
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
谱仪
发射通道数
1通道、2通道、4通道等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
接收通道数
16通道、24通道、48通道等(无限制)
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频发射频率范围
X MHz ± Y kHz
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频接收频率范围
X MHz ± Y kHz
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频稳定性(发射)
幅度:X pk-pk dB
相位:X pk-pk deg
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频稳定性(接收)
幅度:X pk-pk dB
相位:X pk-pk deg
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频频率精度
X Hz
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
梯度输出信号分辨率
X bit/Y伏特
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
AD采样率
X MSPS
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大射频发射带宽
±X kHz
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大射频接收带宽
±X kHz
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
部件安装位置
操作间、扫描间、设备间
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频系统
相位精度
X deg @Y dB
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
发射射频放大器最大输出功率
X kW/通道
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
发射射频放大器最大占空比
100%、50%
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
接收前置放大器噪声
X dB
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
接收前置放大器带宽
X MHz
是
1
部件安装位置
操作间、扫描间、设备间
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
射频线圈
线圈的类型
发射、接收、发射/接收
表面线圈、容积线圈
否
线圈的类型改变,比如接收线圈变为发射/接收线圈,表面线圈变为容积线圈,这些变化对成像的影响较大。
2
预期用途
共振核:1H、19F、23Na、13C、17O应用部位:头部、心脏、关节等
否
预期用途的改变都是均需要进行临床试验。
注:如果应用部位减少或者适用的共振核减少,则可以不再进行临床试验。更改或增加都需要进行临床试验确认。
2
线圈的设计
线性、正交、相位阵列或其他
是/否
线圈内部结构改变可能会对产品成像产生较大影响
1或2
线圈的通道数
4通道、8通道、12通道等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
接收单元具体设计
接收单元设计
是/否
接收单元线路的设计可能会对产品成像产生较大影响
1或2
去耦方法
具体去耦方式
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
线圈材料
聚碳酸酯、乙烯-乙酸乙烯共聚物、玻璃纤维、油漆类型
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
梯度系统
梯度线圈图解
具体图解(包括匀场条位置)
是
1
梯度线圈尺寸
长度:X 米
内径:Y 米
外径:Z 米
是
1
最大峰值电流(Imax)
X 安培
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大峰值电压(Vmax)
X 伏特
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大梯度强度
X mT/m
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大梯度切换率
X T/m/s
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
(上述内容应体现出产品的最大梯度切换率;若有差异,应体现出切换率差异带来的临床影响)
1
梯度线性度
校正前:X1 % @ Y1 DEV
校正后:X2 % @ Y1 DEV
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
屏蔽方式
主动屏蔽、被动屏蔽
是
1
冷却方式
风冷、水冷、油冷等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
噪声(扫描室)
梯度线圈
A加权值: X dB
峰值: Y dB
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
脉冲序列
序列的类型
自旋回波序列家族、梯度回波序列家族、平面回波序列家族
否
对于增加不同的序列家族类型,需要通过临床试验进行验证。
2
预期用途
头部、四肢、身体等
否
预期用途的改变都是均需要进行临床试验。
注:如果应用部位减少,则可以不再进行临床试验。更改或增加都需要进行临床试验确认。
1或2
对比度特性
T1加权、T2加权、质子密度、T2*加权等
否
对比度特性的有效性需要通过临床试验进行验证。
2
门控/触发系统
门控触发方法
呼吸门控、心脏门控、脉搏门控
否
增加或改变的门控触发方法需要非临床确认有无,再由临床试验确认是否有效。
2
连接方式
直接连接、间接连接
是
1
装置及相关部件
心电生理模块、呼吸脉搏模块、无线门控触发单元
是
1
部件安装位置
扫描间
是
需要判断门控信号的传输方式是否受到部件安装位置的改变而改变,如果改变,需要进行非临床研究对部件安装位置对生理信号的影响进行评估。
1
图像处理功能
具体功能及描述
多平面重建、最大强度投影等
是
增加或改变的图像处理功能需要型式检验确认有无,再提供相应的非临床研究/临床试验证据进一步评估安全性和有效性。
1或2
患者支撑装置
安装方式
固定安装、非固定安装
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
是否与系统有电气连接
有、无
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
尺寸
X 米 × Y米×Z米
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
定位精度
重复定位误差±X 毫米
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
最大承重
X 千克
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
升降尺寸
垂直移动行程: X厘米
垂直移动最低高度: Y厘米
是
1
工作站计算机系统
CPU
酷睿i7、酷睿i5等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
内存
512MB、1GB、2GB等
硬盘
1T、2T等
操作系统
Windows 7、Windows 8等
显示器尺寸
22吋 24吋等
显示器类型
液晶、CRT、LED、等离子等
显示器分辨率
1920×1200、1024×768等
图像显示最大灰阶
2.3MP
安装位置
操作间、设备间、扫描间等
定位方式
是否为激光灯定位
是、否
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
部件安装位置
操作间、设备间、扫描间等
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
场地信息及工作条件
场地最小(净)空间等内容
扫描间:长×宽×高 面积
设备间:长×宽×高 面积
操作间:长×宽×高 面积
是
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
1
附件4
同品种磁共振成像系统临床评价报告
产品名称:
型号规格:
完成人员签名:
完成时间:
一、同品种磁共振成像系统判定
拟申报产品与同品种医疗器械对比项目及对比表的格式及内容举例见附件1。
二、评价路径
针对具体情况选择适合的评价路径进行评价,见附件2。
三、针对差异性资料的分析评价
(一)拟申报产品与同品种医用磁共振成像系统相同
说明拟申报产品与对比产品在哪些方面存在差异,参照附件3,并声明针对拟申报产品与对比产品的对比结果选择的评价路径。
(二)拟申报产品与同品种医用磁共振成像系统的差异不对产品的安全有效性产生不利影响
1. 针对差异性的非临床研究资料
(1)研究概述
(2)非临床研究报告
2.针对差异性的临床图像评估资料
3.针对差异性的临床文献数据收集和分析
4.针对差异性的临床经验数据的收集和分析
5.针对差异性的临床试验资料(如有)
6.数据集的建立、统计分析及质量评价
7.小结
四、同品种磁共振成像系统临床试验或临床使用数据分析
1. 概要
概要说明收集到的同品种磁共振产品相关的资料类型和数量,采用的数据质量评价标准和评价结论。
2. 同品种磁共振系统临床数据收集分析
根据同品种产品的预期用途特征,分别列出收集到的所有安全性和有效性相关数据资料,引用的参考文献应提供全文,引用的外文文献应提供翻译为中文的全文。进行文献检索获得的结果应根据《医疗器械临床评价技术指导原则》的要求提供文献检索和筛选方案、文献检索和筛选报告。
所收集的资料的数量和类别应综合考虑对比产品的预期用途特征,并符合《医疗器械临床评价技术指导原则》的要求;通常提供的资料包括如下类别:非临床研究资料(如非临床、拟申报产品与同品种产品的性能参数对比资料等)、临床图像评估数据、临床文献数据(如对国内、国际科学文献数据库进行检索的结果)、投诉和不良事件数据(企业收集的产品安全性、有效性相关数据,国内和国际政府机构建立的数据库中收集的数据)、与临床风险相关的纠正措施数据(产品召回、警告等信息)等。
3. 小结
说明基于收集到的结论进行分析、评估后的结论,结论中应说明对比产品的安全性和有效性评估结果。
五、结论
六、其他需要说明的问题(如适用)
附件二
反馈意见表
序号
页码/章节
修改意见
修改理由
采纳情况及理由
1
2
3
4
5
6
7
8
9
非临床研究、
和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
(上述内容应体现出产品的最大梯度强度;若有差异,应体现出强度差异带来的临床影响)
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等
非临床研究、和/或临床图像评估数据、和/或临床文献数据、和/或临床经验数据等