体外诊断试剂产品注册技术审评报告
产品中文名称:人类SDC2基因甲基化检测试剂盒(荧光PCR法)
产品管理类别:三类 6840
申请人名称: 广州市康立明生物科技有限责任公司
国家食品药品监督管理总局
医疗器械技术审评中心
基本信息
申请人名称 广州市康立明生物科技有限责任公司
申请人住所广州市高新技术产业开发区科学城开源大道11号A2栋第六层
生产地址 广州市高新技术产业开发区科学城开源大道11号A2栋第六层、A4栋第五层(505单位)
产品审评摘要
一、产品概述
(一)产品主要组成成分
表1:试剂盒组成、规格
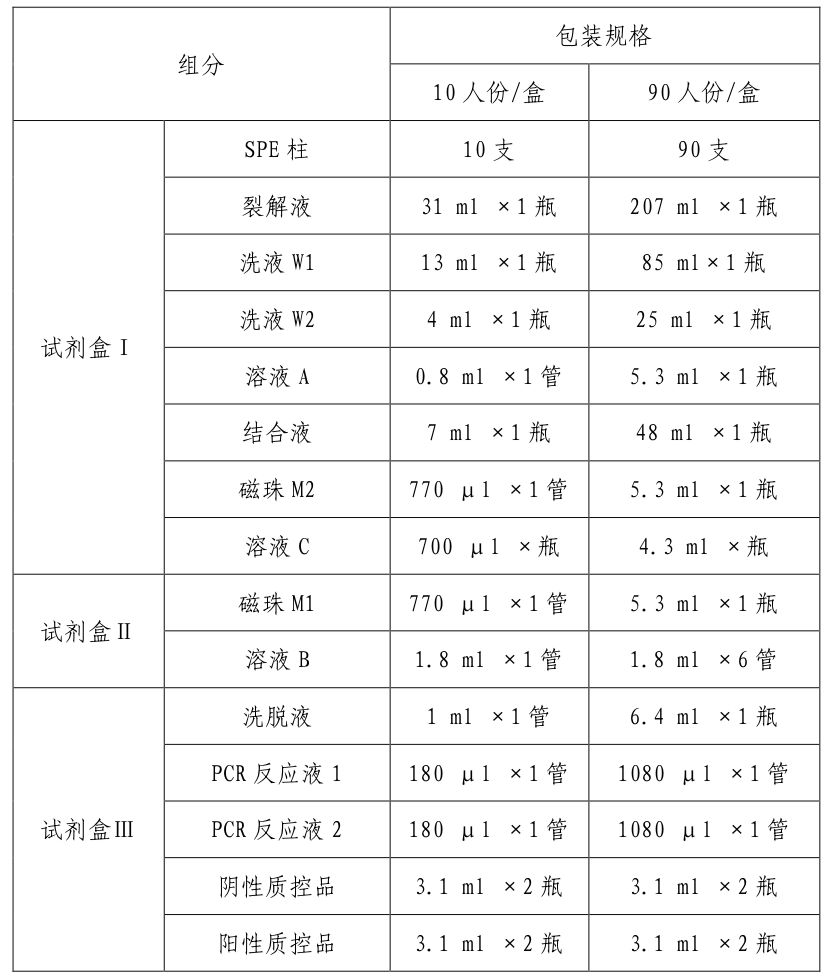
具体各组分的主要成分详见说明书。
(二)产品预期用途
该产品用于体外定性检测人粪便样本中SDC2基因的甲基化情况。
该产品适用于临床医生建议做肠镜检查的患者的辅助诊断,不能作为肿瘤早期诊断或确诊的依据,仅作为辅助诊断供临床医生参考,提供给患者更多一种大肠癌辅助诊断方法的选择。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
(三)产品包装规格
10人份/盒、90人份/盒。
(四)产品检验原理
该产品主要包含提取转化和荧光PCR两个步骤:提取转化步骤是用磁珠捕获的方法提取人粪便样本中的SDC2基因和ACTB(β-actin)基因;然后用亚硫酸盐进行转化未发生甲基化的DNA,发生甲基化的SDC2基因则不会被亚硫酸盐转化。 荧光PCR步骤是通过使用双重荧光PCR的方法在同一个反应孔中检测甲基化的SDC2基因及ACTB基因保守序列。通过特异性的引物来扩增甲基化的SDC2基因,由FAM标记的荧光探针报告扩增信号,甲基化的SDC2基因作为大肠癌诊断的标志物;通过设计保守区域的引物来扩增ACTB基因,由Texas Red标记的荧光探针报告扩增信号。ACTB基因作为内控基因用来评估样品DNA是否足量以及样品DNA质量是否合格。试剂盒中提供阳性质控品、阴性质控品,在每次检测反应中都需要同时检测。
二、临床前研究摘要
(一)主要原材料
1. 主要原材料的选择该产品的主要原材料包括:DNA捕获序列、引物、探针、DNA聚合酶和dNTPs,这些原材料均是通过外购的方式获得。 DNA捕获序列、引物以及探针均由申请人自行设计,由合成公司经过合成、修饰和纯化后获得;DNA聚合酶由原材料供应商克隆表达后获得;dNTPs由供应商化学合成获得。申请人对主要原材料进行了供应商的选择,通过功能性实验筛选出合格供应商,制定了各主要原材料的技术要求和质量标准并经检验合格。
2. 企业参考品和质控品设置情况企业参考品分为SDC2阳性参考品、SDC2阴性参考品、SDC2特异性参考品、SDC2灵敏度参考品和SDC2精密度参考品。质控品分为阳性质控品和阴性质控品。 企业参考品和质控品的制备原料为甲基化SDC2基因比率为100%以及甲基化SDC2基因比率为0%的两株细胞DNA。两株细胞经过扩大化培养、DNA提取、超声破碎、浓度测定和稀释等过程制备成阴性DNA母液和阳性DNA母液。阴性DNA母液和阳性DNA母液经过甲基化特异性PCR以及测序的方法得到验证。 SDC2阳性参考品有7种,分别命名为SDC2阳性参考品P1~P7。SDC2阳性参考品P1~P3为一定DNA浓度下不同甲基化SDC2基因比率的样本;SDC2阳性参考品P4~P7为不同DNA浓度的样本。 SDC2阴性参考品有8种,分别命名为SDC2阴性参考品N1~N8。SDC2阴性参考品N1~N6为一定DNA浓度下分别含有不同干扰物质的样本;SDC2阴性参考品N7为一定DNA浓度下含有低于检测灵敏度的甲基化SDC2基因的样本;SDC2阴性参考品N8为一定DNA浓度下不含甲基化SDC2基因的样本。 SDC2特异性参考品1种,命名为SDC2特异性参考品T。SDC2特异性参考品T为一定DNA浓度下含有其他甲基化基因的样本。 SDC2精密度参考品2种,分别为SDC2精密度参考品J1和SDC2精密度参考品J2。SDC2精密度参考品J1为低浓度的样本,SDC2精密度参考品J2为高浓度的样本。 SDC2灵敏度参考品为一定DNA浓度的阴性样本和阳性样本的混合,其中阳性的比率为1%。 SDC2阴性质控品和阳性质控品分别为一定浓度的阴性DNA样本和阳性DNA样本,用于检测过程中试剂和仪器的质量控制。此外,每一个反应中均检测内参基因ACTB,用于结果的判读及监测样本的质量。
(二)生产工艺及反应体系研究
申请人对试剂盒反应体系的研究中包括DNA捕获序列的组合、裂解条件的选择、MgCl2浓度的确定、dNTPs浓度的确定、引物探针浓度的确定、DNA聚合酶浓度的确定以及阴/阳性质控品浓度等;对PCR过程中的循环数、退火温度及退火时间进行研究;完成样本的用量以及样本保存时间的研究;对该产品适配的两种仪器Roche LightCycler 480 II以及ABI 7500的检测结果的判读的方式和阈值进行了研究。通过功能性实验,最终确定了最佳的反应体系。申请人根据试剂盒中试剂及组件的主要生产工艺的研究结果,确定了最佳的生产工艺。
(三)分析性能评估
分析性能评估包括试剂盒外观、灵敏度、特异性、阴/阳性符合率、精密度以及干扰试验的研究。在试剂盒外观的研究中,选择连续生产的三批次试剂盒,主要针对试剂盒组分是否齐全,包装外观清洁、无泄露、无破损,标志、标签字迹清楚等情况进行目视观察。结果显示试剂盒外观符合质量的要求。灵敏度研究的目的是考察在一定量的野生型的DNA背景下能够检测的阳性样本最低的比例。分析方法是将2ng/μL的阴/阳性细胞株基因组DNA按照6个梯度的方式将两种细胞株基因组DNA混匀。使用两种规格(10人份/盒、90人份/盒)六批次试剂盒分别在两种适配的仪器上进行检测,确定试剂盒检测的灵敏度。该灵敏度的研究也同时在粪便样本为基质的样本中完成检测。检测结果显示该产品在DNA浓度为2ng/μL的野生型DNA背景下的灵敏度为1%。 特异性研究的方法是分别选取7例经过临床肠镜确诊为正常人的粪便样本,选取2例其他基因(BMP3)甲基化的DNA样本,选取SDC2特异性参考品T,使用两种规格(10人份/盒、90人份/盒)六批次试剂盒分别在两种适配的仪器上进行检测。检测结果均为甲基化SDC2基因扩增为阴性,说明该产品能够实现对甲基化SDC2基因的特异性检测。阴/阳性符合率的研究,阴性符合率中需检测的样本类型为包括含有不同类型的可能干扰实验检测的常用药物的样本、不含有干扰药物的样本、含有低于该产品灵敏度的甲基化样本;阳性符合率的检测样本包括固定DNA含量一定且含不同的甲基化阳性DNA比率的样本、不同的DNA浓度梯度的样本。使用两种规格(10人份/盒、90人份/盒)六批次试剂盒分别在两种适配的仪器上进行检测。检测结果的显示阴性符合率为100%;阳性符合率为100%。 精密度的研究分别选择低DNA浓度及高DNA浓度的精密度参考品J1和精密度参考品J2。使用两种规格(10人份/盒、90人份/盒)六批次试剂盒分别在两种适配的仪器上由两位实验人员在20天进行连续的检测。检测结果显示两种规格的试剂盒在两种适配仪器上的变异系数均小于等于5%。在干扰试验中,选择潜在的干扰物进行研究,包括常用乳液、面霜及女性常用非处方产品,粪便软化剂、抗腹泻及泻药产品,抗酸及其他胃药,抗炎症类药、止痛药,动植物DNA,脂肪酸和油脂类物质。实验结果显示动物DNA(500ng/ml)、植物组织(500ng/ml)、植物油(10μl/ml)、通便类药物甘露醇(75mg/ml)、通便灵胶囊(7.25mg/ml)、痔疮膏(24.75mg/ml)、吗丁啉(0.14mg/ml)、四环素(10.65mg/ml)、青霉素(2.56mg/ml)、布洛芬胶囊75μg/ml、胃药斯达舒(6.84mg/ml)、奥美拉唑(2.82mg/ml)、头孢克肟(20.5mg/ml)、盐酸左氧氟沙星(0.15mg/ml)、西咪替丁(2mg/ml)、感冒灵胶囊(0.27mg/ml)对检测结果无影响。浓度为3倍正常代谢量(9.23mg/ml)的黄连素对该产品的检测影响超出允许标准。因此,建议该产品在临床使用中,受检者在本检测取样前1天避免服用黄连素。
(四)阳性判断值
该产品阳性判断值的研究采用临床来源粪便样本。465例中结直肠癌患者120例、腺瘤(≥10mm)76例、肠息肉样本(<10mm)31例、肠炎样本24例、胃炎样本6例、胃癌样本18例、胃息肉样本1例,神经内分泌瘤样本3例、肝癌和肠道脂肪瘤样本各1例、正常人184例。试验结果显示ACTB基因的Ct值在22至40之间,取95%分位值,Ct值≤36时判定为样本合格。在确定样本质量合格的情况下,根据临床对于检测灵敏度和特异性的需求分析,判定检测样本SDC2基因Ct值≤38时判断为阳性;SDC2基因Ct值>38时判断为阴性。因此,该产品的阳性判断值为: ACTB基因的Ct值≤36,甲基化SDC2基因Ct值≤38时判断样本为阳性; ACTB基因的Ct值≤36,甲基化SDC2基因Ct值>38时判定为阴性样本; ACTB基因Ct值>36或者无Ct值时,判定为样本不合格。
(五)稳定性
申请人对该产品的稳定性的研究包括货架效期稳定性、开封稳定性、反复冻融稳定性、运输稳定性以及热稳定性。货架效期稳定性:选择三批次试剂盒,定期对规定储存条件下保存的试剂盒进行检测,验证其货架效期稳定性;并记录实验结果和日期,形成报告。其三批次的货架效期稳定性项目的检测频次分别为如下所述: SD11611001:自生产之日起在第一个月、第三个月、第四个月检之后每个月检测一次直至第14个月,研究测试剂盒的货架效期稳定性; SD11612001:自生产之日起每月检测一次直至第14个月,研究试剂盒的货架效期稳定性。 SD11612002:自生产之日起每月检测一次直至第14个月,研究试剂盒的货架效期稳定性。 对各项参考品及阴/阳性质控品检测的实验结果表明:该产品在生产后14个月的产品性能满足质量的要求,试剂性能稳定。产品有效期可达12个月。 开封稳定性:取一定量的效期内三批次试剂盒,开封使用状态下放置1天、2天、1周后检测试剂盒的稳定性。对各项参考品及阴/阳性质控品检测的实验结果表明该产品开封使用状态下放置1天、2天和1周后,其检测结果显示试剂盒的产品性能均能够满足质量的要求,因此该产品在开封使用条件下存放时间可以达到1周。 反复冻融稳定性:使用三批次试剂盒在规定的储存条件下,取出试剂盒III反复冻融4次,检测每次冻融后的试剂盒的稳定性;将试剂盒III放置在冰箱4℃解冻后放回-20℃±5℃保存,反复冻融4次,每次冻融检测1次。对各项参考品及阴/阳性质控品检测的实验结果表明试剂盒III在反复冻融4次的条件下的产品性能均能够满足质量的要求。因此声称试剂盒III反复冻融不超过4次。 运输稳定性:使用三批次试剂盒进行冷链运输;对运输后及运输后放置到有效期末的试剂盒进行检测。对各项参考品及阴/阳性质控品检测的实验结果表明该产品在冷链运输的条件下运输6天以及在效期末的检测结果的各项性能指标均能够满足质量的要求。试剂盒的运输时间在6天内不影响产品质量。 热稳定性:将三批次试剂盒放置在37℃的鼓风烘箱中,每天检测一次,连续三天检测。对各项参考品及阴/阳性质控品检测的实验结果表明三批次试剂盒37℃放置3天的测试结果在外观性状、阴/阳性符合率、灵敏度、特异性、精密度都满足质量要求。申请人对粪便样本保存稳定性以及该产品提取的DNA样本的保存稳定性进行研究。结果显示粪便样本保存时间期限可达8个月;该产品提取的DNA样本保存时间可达1个月。
三、临床评价摘要
申请人在中山大学附属第六医院、南方医科大学南方医院和山东省肿瘤医院共3家临床试验机构完成了临床试验。
采用肠镜(和)或病理的等临床诊断结果为对照方法,通过与临床参考方法对比验证考核试剂的有效性和安全性,从而评估考核产品的临床性能。通过采用单盲、对照的试验设计共筛选入了1381例受试者,有效病例数为1213例。其中结直肠癌病例374例,非结直肠癌病例839例。结直肠癌病例涵盖了结直肠癌不同分期的患者,占总入组病例数的30.83%(374/1213)。非结直肠癌病例包括干扰人群样本共551例,其中含437例肠道相关良性疾病人群样本(主要包括结直肠腺瘤110例、结直肠息肉114例、结直肠炎症151例、痔疮47例以及憩室、肿物、大肠黑变病、脂肪瘤等)、59例消化道炎症或肿瘤人群样本(主要包括胃癌18例、食管癌12例、胃炎11例、食管炎8例以及肝癌、胆管癌、阑尾恶性肿瘤、胰腺癌、喉鳞癌、十二指肠癌等)、55例其它肿瘤样本或疾病人群样本(主要包括黑色素瘤2例、神经内分泌癌5例、乳腺癌4例、微生物消化道感染10例、宫颈癌1例、肺癌6例、肺鳞癌8例、前列腺癌10例、类风湿性关节炎8例以及宫颈鳞癌1例)。另外入组288例肠道正常人群样本。 将1213例有效病例对照方法结果与考核试剂检测结果进行比较,检测结果如下表所示:
表2:对照方法与考核试剂检测结果统计四格表
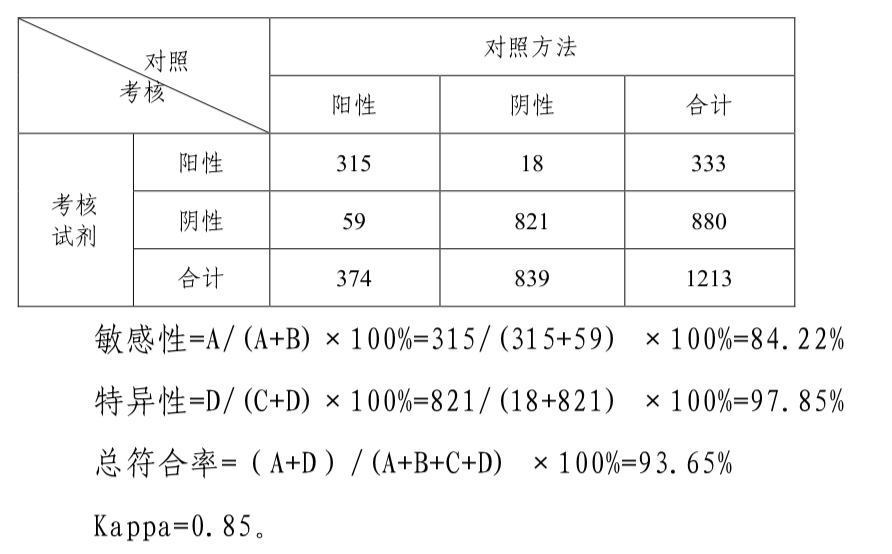
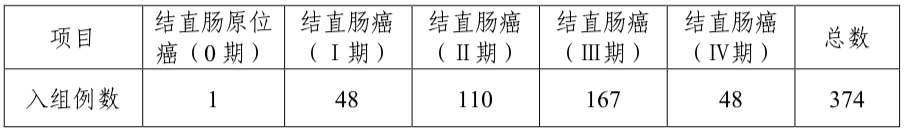
临床试验结果显示,1213例有效病例中,有77例样本考评试剂盒检测结果与对照方法不符,其中假阳性18例(主要集中在肠道相关良性疾病病例,包括息肉6例、肠炎3例、重度异型增生2例以及腺瘤、胃炎等),假阴性59例。对1213例有效病例进行统计分析,结果表明考核试剂对结直肠癌样本的检测敏感性为84.22%(315/374),特异性为97.85%(821/839),总符合率为93.65%(1136/1213),Kappa值为0.85。对三家临床试验机构入组的374例不同分期结直肠癌患者结果分别进行统计,结果见下表:
表3:大肠癌临床分期样本检测结果
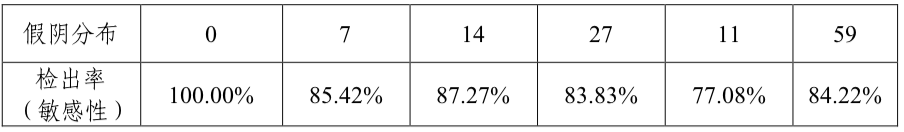
由结果可见,在结直肠癌的不同分期,该指标的检出无显著差异。
对77例考核试剂与对照方法不符的样本和31例临床试验中与对照方法符合的样本(包括肠癌、肠道未见异常、肠炎、痔疮、息肉、胃癌、食管癌、神经内分泌癌、前列腺癌、肝癌、肺癌和类分湿性关节炎样本,覆盖了入组临床试验的各主要样本病例类型)进行测序,结果显示测序结果与试剂盒检测结果一致性为100%,说明该产品能够实现对SDC2基因甲基化的特异性的检测。 在临床试验中还对40例结直肠癌切除根治术前、后的受试者进行了短期随访。使用考核试剂对符合短期随访要求的受试者粪便样本进行检测,检测结果显示39例检测全为术前与病理结果相符,术后阴性与结直肠癌手术后的结果相符。其中有1例考核试剂检测结果为样本不合格。
综上所述,考核试剂临床试验对该产品的临床性能进行了较全面研究,临床试验符合要求。
四、风险分析及说明书提示
根据“YY/T 0316-2016 医疗器械风险管理对医疗器械产品的安全风险分析方式,对人类SDC2基因甲基化检测试剂盒(荧光PCR法)进行风险分析。
(一)受益评估
根据中国癌症协会公布的数据:2015年我国大肠癌新发比例约39万,死亡约19万,并且呈现逐年快速上升的势头。目前大肠癌检测的金标准为肠镜检查,该试剂盒适用于临床医生建议做肠镜检查的患者的辅助诊断,不能作为肿瘤早期诊断或确诊的依据,仅作为辅助诊断供临床医生参考,提供给患者更多一种大肠癌辅助诊断方法的选择。依据现有临床试验结果,对结直肠癌的临床灵敏度为84.22%,特异性为97.85%。
(二) 风险评估
该试剂盒已知和可预见的安全风险主要有以下几个方面:
1. 与生物学危害有关的安全风险,例如粪便样本可能存在传染性物质。
2.与环境有关的危害,例如试剂盒生产及检验中的废液的分类处理问题。
3. 与使用有关的安全风险,例如使用仪器和试剂时没有按照说明书要求进行操作。
4. 与运输与储存有关的安全风险,例如试剂的运输和储存超出规定条件。
5. 与预期用途有关的安全风险,例如本产品的检测结果非唯一诊断依据,医生未结合其他诊断方法进行综合诊断。阳性结果不能作为确诊依据,阴性结果也不能作为排除的依据。 6. 功能性失效引起的安全风险,例如未按取样要求取样、样本不合格等导致的检验失败。7. 与生产有关的安全风险,例如使用未经过验证的原材料。 该试剂盒的产品实现的全生命周期中通过对环境的监测、生产的监控、原材料及供应商的管理、半成品及成品的检验以及说明书的警示内容等方式对安全风险进行控制和降低,剩余风险可以被控制在验收准则规定的可接受范围内,同时没有带来新的危害与安全风险。在目前认知水平上,认为该产品上市带来的获益/受益大于风险。
产品说明书中对于安全风险的提示信息如下:
1. 产品检测的样本为粪便样本,取样量在1.5g-10g之间。
2. 患者提供的粪便样本必须使用广州市康立明生物科技有限责任公司生产的粪便采集装置收集,3天内寄送至检测机构。
3. 黄连素(9.23mg/ml)对检测结果有影响,因此患者取样前1天应注意勿服用药物黄连素。
4. 样本的收集、存储以及DNA的提取和亚硫酸盐的处理需要按照要求进行,否则可能影响检测结果导致假阴性和假阳性的发生。
5. 本检测试剂盒检测结果仅供临床参考不得作为临床确诊的依据,应结合其他临床诊断结果进行判定。判定为阳性的患者,建议接受结肠镜检查以便确诊;判定为阴性的患者不排除患病的可能;判定为无效结果的样本,建议患者重新取样检测。
6. 产品的说明书中同时描述了相关注意事项。
综合评价意见
本申报项目为境内第三类医疗器械产品注册,属于创新审批项目(编号:201600150)。申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第680号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令2014年第5号)等相关医疗器械法规与配套规章,经系统评价后,建议准予注册。
2018年11月8日
附件
人类SDC2基因甲基化检测试剂盒(荧光PCR法)说明书
【产品名称】 通用名称:人类SDC2基因甲基化检测试剂盒(荧光PCR法)
【包装规格】 10人份/盒,90人份/盒。
【预期用途】 本试剂盒用于体外定性检测人粪便样本中SDC2基因的甲基化情况。
本试剂盒适用于临床医生建议做肠镜检查的患者的辅助诊断,不能作为肿瘤早期诊断或确诊的依据,仅作为辅助诊断供临床医生参考,提供给患者更多一种大肠癌辅助诊断方法的选择。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
DNA异常的高度甲基化与癌症的发生发展相关,有研究分析了大肠癌患者的癌组织以及癌旁组织的甲基化情况,筛选出具有显著差异的甲基化SDC2基因[1]。在粪便样本的SDC2基因甲基化的研究中发现在特异性为90.9%时,大肠癌的检测敏感性为90.0%[2]。相对于正常组织,SDC2基因在大肠癌和腺瘤组织中呈现高水平的甲基化现象,并且SDC2基因在大肠癌和腺瘤组织中的表达也显著高于正常组织[3]。SDC2基因在大肠癌不同分期中呈现高度的甲基化,这一现象预示着其作为大肠癌诊断标志物具有较高的价值[1-3]。
【检验原理】 本试剂盒主要包含提取转化和荧光PCR两个步骤:提取转化步骤是用磁珠捕获的方法提取人粪便样本中的SDC2基因和ACTB(β-actin)基因;然后用亚硫酸盐进行转化未发生甲基化的DNA,发生甲基化的SDC2基因则不会被亚硫酸盐转化。 荧光PCR步骤是通过使用双重荧光PCR的方法在同一个反应孔中检测甲基化的SDC2基因及ACTB基因保守序列。通过特异性的引物来扩增甲基化的SDC2基因,由FAM标记的荧光探针报告扩增信号,甲基化的SDC2基因作为大肠癌诊断的标志物;通过设计保守区域的引物来扩增ACTB基因,由Texas Red标记的荧光探针报告扩增信号。ACTB基因作为内控基因用来评估样品DNA是否足量以及样品DNA质量是否合格。试剂盒中提供阳性质控品、阴性质控品,在每次检测反应中都需要同时检测。
【主要组成成分】 1. 试剂盒中包含的试剂组份 本试剂盒根据试剂不同的保存条件要求,分成如下三个试剂盒:
表1:试剂盒组成、规格及主要成分

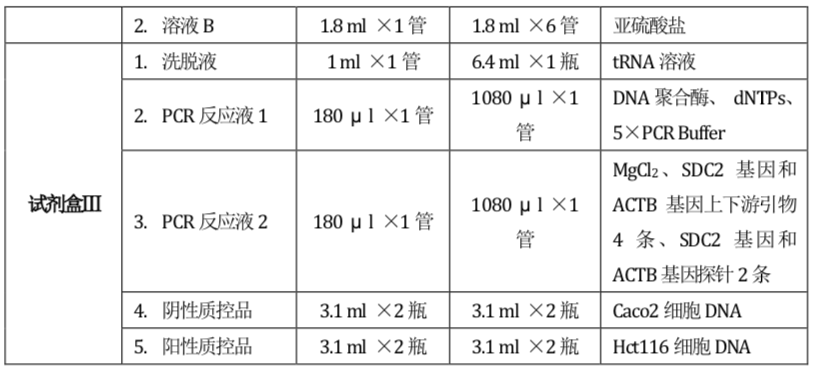
注:不同批号试剂盒中的各组分不可以互换。
2.产品不包含,需自备的试剂和仪器
仪 器 类:台式离心机、水浴锅、磁力架、移液器(规格:10μl、100μl、1000μl、5 ml) 试剂耗材类:实验需要但试剂盒中不包含的有无水乙醇、10 ml离心管、带滤芯枪头(规格:10μl、100μl、1000μl、5 ml)、2 ml离心管、8联管或者96孔板、96孔板封口膜及压膜器。
【储存条件及有效期】 试剂盒Ⅰ常温储存;试剂盒Ⅱ需2℃-8℃密封储存;试剂盒III 需-20℃±5℃密封储存。试剂盒有效期为12个月。 试剂盒Ⅲ反复冻融不超过4次,打开包装后1周内可在2℃-8℃储存,长期储存请放置于-20℃±5℃(建议开封后即分装)。试剂盒Ⅱ、试剂盒Ⅲ运输过程中需要保持合适温度,运输时间不超过6天。
【适用仪器】 Roche LightCycler 480 Ⅱ、ABI 7500。 注意: 1. 使用ABI7500仪器检测时探针模式的设置,报告基因:FAM、TexasRed;猝灭基团:NONE;参比荧光:NONE。反应体积为30μl。 2. 使用RocheLightCycler 480 Ⅱ仪器检测时需要选择荧光通道:FAM(465-510nm)、Texas Red(533-610nm)。反应体积30μl。
【样本要求】 1. 检测样本类型:粪便样本,取样量在1.5g~10g之间。 2. 患者提供的粪便样本必须使用广州市康立明生物科技有限责任公司生产的粪便采集装置收集,3天内寄送至检测机构。 3. 检测机构在收到样本后建议立刻进行DNA的提取及亚硫酸盐的处理、荧光PCR的检测,否则建议将含有样本保存液的粪便样本振荡混匀,冻于-80℃±5℃冰箱,保存期不超过6个月。4. 本试剂盒提取和亚硫酸盐处理的DNA不适于测定OD260来定量;不适于通过OD260/OD280来判定样本质量。 5. 提取和亚硫酸盐处理完的DNA建议立即检测,否则请于-20℃以下保存,保存时间不要超过1个月。
【检验方法】
1. 核酸提取及转化工作液的准备
1.1 90人份工作液的准备
1.1.1 洗液W2的准备
* 将100 ml无水乙醇加入洗液W2中,盖好盖后上下颠倒6次混匀。在标签的侧面“已加入无水乙醇”的方框“□”内标记“√”号。
1.1.2 溶液C的准备
* 将17 ml无水乙醇加入溶液C中,盖好盖后上下颠倒6次混匀。在标签的侧面“已加入无水乙醇”的方框“□”内标记“√”号。(注意:该试剂要现配现用,溶液C与无水乙醇的体积比例是1:4)
1.2 10人份工作液的准备
1.2.1 洗液W2的准备
* 将16 ml无水乙醇加入洗液W2中,盖好盖后上下颠倒6次混匀。在标签的侧面“已加入无水乙醇”的方框“□”内标记“√”号。
1.1.2 溶液C的准备
* 将2.8 ml无水乙醇加入溶液C中,盖好盖后上下颠倒6次混匀。在标签的侧面“已加入无水乙醇”的方框“□”内标记“√”号。(注意:该试剂要现配现用,溶液C与无水乙醇的体积比例是1:4)
2. 粪便核酸提取及转化
2.1 粪便样本、阴性质控品以及阳性质控品的融化
* 分别将1份阴性质控品、1份阳性质控品和待检测的粪便样本置于2~8℃过夜解冻,取出样本管,擦去管外壁水珠将粪便样本混合均匀。(注意:样品解冻后,应立即进行下一步操作)
2.2 离心
* 将粪便样本5000 rpm离心10分钟。
* 取9ml上清转移至新的10 ml离心管中,5000rpm离心10分钟。
2.3 过柱
* 取3.2 ml离心后的悬浮液加入到SPE柱中,5000 rpm离心5分钟。(剩余的上清可置于-80±5℃保存)
2.4 弃柱
* 弃SPE柱内柱。
* 将解冻的阴性质控品、阳性质控品各3 ml分别加到新的10 ml离心管中。
2.5 裂解
* 在样本、阴性质控品、阳性质控品中分别加入裂解液2 ml,同时加入磁珠M1 50 μl,盖好盖后振荡混匀。(注意:磁珠M1加入前请振荡混匀,观察管底无明显的沉淀物后再加入;磁珠M1与磁珠M2不能混用。)
2.6 孵育
* 将离心管放置在干浴器上,95℃孵育15分钟后取出离心管快速摇匀,室温(20℃~30℃)条件下静置1小时。(注意:离心管静置时应自然降温,避免快速降温的因素。)
2.7 转移
* 1500 rpm离心10sec后将离心管置于磁力架5分钟,吸弃4.2 ml液体,将剩余液体以及磁珠转移至新的2 ml离心管中。
* 将离心管涡旋振荡至肉眼无可见的磁珠团块,简短离心后将离心管置于磁力架1-3分钟,吸弃液体。(注意:涡旋振荡效果影响实验的结果,应使磁珠充分分散。)
2.8 第一次洗涤
* 加入800μl洗液W1,涡旋振荡至肉眼无可见的磁珠团块后简短离心,将离心管置于干浴器中室温1300 rpm振荡孵育1分钟,简短离心后将离心管置于磁力架1-3分钟,吸弃液体。(注意:涡旋振荡效果影响实验的结果,应使磁珠充分分散;洗液W1与洗液W2不能混用)
2.9 转化
* 加入50μl溶液A涡旋振荡将管壁磁珠洗下来,简短离心室温1300 rpm振荡20分钟,简短离心;将离心管置于磁力架1-3分钟,使用移液器转移溶液至新的离心管。
* 加入100μl溶液B,混匀后简短离心,干浴器65℃孵育70分钟后简短离心。
2.10 纯化
* 加入450 μl结合液以及50 μl磁珠M2,室温1300 rpm振荡孵育15分钟,简短离心置于磁力架1分钟,吸弃液体;再次简短离心置于磁力架1分钟,吸弃液体。 (注意:磁珠M2加入前请振荡混匀,观察管底无明显的沉淀物后再加入;磁珠M2与磁珠M1不能混用。)
2.11 第二次洗涤
*加入800 μl洗液W2,使用移液器轻轻吹散磁珠,将磁珠转移至一个新的2ml离心管中。室温干浴器1300 rpm振荡混匀1分钟后简短离心,置于磁力架1分钟,吸弃液体。
2.12 脱磺酸基团
* 加入200μl已经加入无水乙醇的溶液C室温1300rpm振荡孵育15分钟,简短离心置于磁力架1分钟,吸弃液体。
2.13 第三次洗涤
* 加入200 μl洗液W2,室温干浴器1300rpm振荡混匀1分钟后置于磁力架1分钟,简短离心,吸弃液体。
2.14第四次洗涤
* 加入200 μl洗液W2,室温干浴器1300rpm振荡混匀1分钟后简短离心,置于磁力架1分钟,吸弃液体。
2.15 干燥
* 打开离心管室温干燥10分钟。(注意:不要增加干燥温度和干燥时间,不需要振荡) 2.16 洗脱
* 将洗脱液放置在冰盒上自然融化,加入60 μl洗脱液,干浴器65℃,1300rpm孵育10分钟,简短离心置于磁力架上1分钟,将洗脱下来的溶液转移至新的离心管中,盖好管盖并且标记。
3. 扩增试剂准备(PCR反应液配置区)
3.1 将PCR反应液1以及PCR反应液2插入冰盒中,自然融化。
3.2 按照以下反应体系加入各种成分。
表2:PCR反应加样方式

3.3 加样完成后,充分混匀后离心,将PCR管放入PCR仪中。
3.4 按照下面步骤设置PCR的反应条件(下表):
表3:PCR反应程序
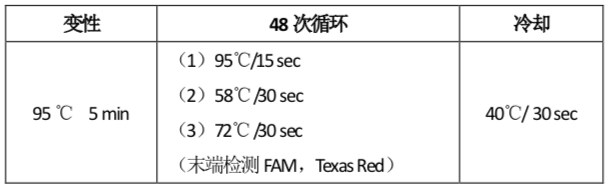
3.5分析条件设置:Roche LightCycler 480 II仪器结果分析时使用AbsQuant/2nd Derivative Max分析方法分析扩增的循环数;ABI 7500仪器结果分析时使用仪器默认基线,SDS V2.3.1软件分析时,FAM通道(检测SDC2基因)值设置为65000,TexasRed通道(检测ACTB基因)阈值设置为95000。FAM通道和Texas Red通道扩增曲线呈现“S”型扩增才可计算Ct值。
【阳性判断值】 本试剂盒检测临床样本,得到465例有效数据中结直肠癌患者120例、腺瘤(≥10mm)76例、肠息肉样本(<10mm)31例、肠炎样本24例、胃炎样本6例、胃癌样本18例、胃息肉样本1例,神经内分泌瘤样本3例、肝癌和肠道脂肪瘤样本各1例、正常人184例。样本的ACTB基因的Ct值在22至40之间,取95%分位值,Ct值≤36时判定为样本质量合格。在阳性判断值的选择时根据到临床的需要,在样本质量合格的条件下选择SDC2基因Ct值≤38为阳性结果;SDC2基因Ct值>38时为阴性结果。检测结果显示在检测特异性为92.2%时(248/269)结直肠癌患者的检测灵敏度为82.25%(99/120),腺瘤患者的检测灵敏度为47.4%(36/76)。31例息肉样本检测结果为4例阳性27例阴性。肠炎患者样本24例检测结果为1例阳性23例阴性;胃炎疾病患者样本6例检测结果为阴性;胃癌患者样本18例检测结果为1例阳性17例阴性;胃息肉1例检测结果为阴性;肝癌患者样本1例检测结果为阴性;肠道脂肪瘤患者样本1例检测结果为阴性。神经内分泌瘤样本3例检测结果为阴性。 因此,本试剂盒的阳性判断值为:ACTB基因的Ct值≤36,甲基化SDC2基因Ct值≤38时判断样本为阳性;ACTB基因的Ct值≤36,甲基化SDC2基因Ct值>38时判定为阴性样本;ACTB基因Ct值>36或者无Ct值时,判定为样本不合格。
【检验结果的解释】
1. 试验结束以后运行Ct值的计算,运行无模板对照(NTC)的Ct值≥40或者没有出现扩增曲线时,说明试验无污染存在,可以继续分析试验情况。
2. 运行阳性质控品、阴性质控品FAM通道,阳性质控Ct值≤35时,阴性质控Ct值≥40或者无Ct值;Texas Red通道阴性质控品、阳性质控品Ct值均≤35时,说明实验体系正常,可以继续分析实验。
3. 在检测样本反应孔中Texas Red通道,一般Ct值≤36,可以继续分析,如果Ct值>36则说明样本DNA量不足或者降解严重,不适合实验分析。
4. 在检测样本反应孔FAM通道中,在没有出现扩增曲线或者Ct值>38的样本为阴性。出现S型扩增曲线且Ct值≤38的样本为阳性。
5. 判定为阳性的样本的患者,建议进行肠镜检查以确诊;判定为阴性的患者不排除患病的可能;判定为样本不合格的,建议患者重新取样检测。
6. 干扰实验结果显示:粪便样品中分别含有以下物质:动物DNA(500ng/ml)、植物组织(500ng/ml)、植物油(10μl/ml)、通便类药物甘露醇(75mg/ml)、通便灵胶囊(7.25mg/ml)、痔疮膏(24.75mg/ml)、吗丁啉(0.14mg/ml)、四环素(10.65mg/ml)、青霉素(2.56mg/ml)、布洛芬胶囊75μg/ml、胃药斯达舒(6.84mg/ml)、噢美拉唑(2.82mg/ml)、头孢克肟(20.5mg/ml)、盐酸左氧氟沙星(0.15mg/ml)、西咪替丁(2mg/ml)、感冒灵胶囊(0.27mg/ml)对检测结果无影响。
【检测方法的局限性】
1. 本检测试剂盒仅能检测使用本公司生产的粪便样本收集装置收集的粪便样本。其他途径收集的粪便样本不适用于本试剂盒的检测。
2. 样本的收集、存储以及DNA的提取和亚硫酸盐的处理需要按照要求进行,否则可能影响检测结果导致假阴性和假阳性的发生。
3. 本检测试剂盒检测结果仅供临床参考不得作为临床确诊的依据,应结合其他临床诊断结果进行判定。判定为阳性的患者,建议接受结肠镜检查以便确诊;判定为阴性的患者不排除患病的可能;判定为无效结果的样本,建议患者重新取样检测。
【产品的性能指标】
1. 外观: 试剂盒组份齐全;包装外观清洁、无泄露、无破损;标志、标签字迹清楚。
2. 阴/阳性符合率
2.1 阴性符合率:检测8份SDC2阴性参考品(N1~N8),甲基化SDC2基因扩增结果应均为阴性。
2.2 阳性符合率:检测7份SDC2阳性参考品(P1~P7),甲基化SDC2基因扩增结果应均为阳性。
3. 特异性:检测1份SDC2特异性参考品T,甲基化SDC2基因扩增结果呈阴性。
4. 灵敏度:检测SDC2灵敏度参考品L 20次,至少17次甲基化SDC2基因扩增呈阳性。
5. 精密度:分别检测SDC2精密度参考品J1、SDC2精密度参考品J2各10次,结果满足甲基化SDC2基因扩增呈阳性,同时内参基因ACTB扩增曲线正常。计算甲基化SDC2基因以及内参基因ACTB的Ct值的变异系数(CV)均不高于5%。
6. 在多中心临床试验中,对1213例有效病例进行统计分析,结果表明本试剂盒对结直肠癌样本的检测敏感性为84.22%(315/374),特异性为97.85%(821/839),总符合率为93.65%(1136/1213),Kappa值为0.85。其中有10例肠癌样本其SDC2基因38<Ct值≤39,也应引起临床的重视。
【注意事项】
1. 本试剂盒仅用于体外诊断,使用前请详细阅读说明书并必须严格按照说明书进行操作。 2. 应由具备专业经验或经培训合格的人员进行操作。
3. 有关实验室管理规范请严格按照行业行政主管部门颁布的有关基因扩增检验实验室的管理规范执行。
4. 实验室应按试剂准备区、样本处理区、反应液配置区、扩增检测分析区分隔使用。工作流程:操作过程应工作服、帽、鞋、手套等穿戴齐全,各区物品均为专用,不得交叉使用,避免污染。
5. 反应液分装时应尽量避免产生气泡,并注意防止泄漏,以免荧光物质污染仪器。
6. 实验过程中若出现标本及试剂污染工作台及移液器,应及时用10%次氯酸钠或75%酒精处理。实验结束后应立即清洁工作台,并定期对工作台及各种实验用品进行消毒。
7. 不要使用超过有效期的试剂,不同批次的产品不能混用。
8. 加样所用的加样器需要定期检测,保证加样的准确性
9. 溶液B为亚硫酸盐溶液,操作时勿接触皮肤和眼睛;如果接触到应迅速擦干净用大量的水冲洗。
10. 黄连素(9.23mg/ml)对检测结果有影响,因此患者取样前1天应注意勿服用药物黄连素。
11. 为了避免样本中任何潜在的生物危险,检测样本应视为具有传染性物质,避免接触到皮肤和粘膜;样本的处理建议在可防止气雾外流的生物安全柜中操作,样本制备区所用过的试管、吸头需打入盛有消毒剂的容器,并与废弃物一起灭菌后方可丢弃;样本操作和处理均需符合相关法规要求:卫生部《微生物生物医学实验室生物安全通用准则》和《医疗废物管理条例》。
【标识的解释】

【参考文献】
1. Tae Jeong oh, Sungwhan An, Genome-wideidentification and validation of a novel methylation biomarker、SDC2、for blood-based detection of colorectal cancer, The journal ofMolecular Diagnostics, July 2013 vol,15,No.4.
2. Tae Jeong Oh, et al, Feasibility ofquantifying SDC2 methylation in stool DNA for early detection of colorectalcancer: The Journal of Clinical Epigenetics: 2017.
3. Niu F, Wen J, Fu X, et al. Stool DNATest of Methylated Syndecan-2 for the Early Detection of ColorectalNeoplasia[J]. Cancer Epidemiology Biomarkers &Prevention,2017,26(9):1411-1419.
【基本信息】
注册人/生产企业名称:广州市康立明生物科技有限责任公司 注
册人/生产企业住所:广州高新技术产业开发区科学城开源大道11号A2栋第六层
售后服务单位名称:广州市康立明生物科技有限责任公司
联系方式: 020-82510982
邮 编:510535
网址:www.creativebio.cn
Email:Service@creativebio.cn
生产地址:广州高新技术产业开发区科学城开源大道11号A2栋第六层、A4栋第五层(505单位)。
生产许可证编号:
【医疗器械注册证编号/产品技术要求编号】
【说明书核准及修改日期】