重庆市药品技术审评认证中心关于公开《一次性无菌变向磨头产品技术审评报告》的通告
为贯彻落实药品医疗器械审评审批制度改革工作要求,提升第二类医疗器械审评审批公开透明度,重庆市药品技术审评认证中心公开《一次性无菌变向磨头》医疗器械产品技术审评报告。
附件:一次性无菌变向磨头产品技术审评报告.docx
附件:
受理号:X200346
重庆市境内第二类医疗器械注册
技术审评报告
重庆市药品技术审评认证中心
基本信息
一、申请人名称
二、申请人住所
重庆市北部新区高新园木星科技发展中心(黄山大道中段9号)
三、生产地址
重庆市北部新区高新园木星科技发展中心(黄山大道中段9号)
产品审评摘要
一、产品概述
(一)产品结构及组成
(二)型号规格
DRC20A1S、DRC25A1S、DRC30A1S、DRC35A1S、DRC35B1S、DRC40B1S、DRC45B1S、DRC50B1S、SRC20A1S、SRC25A1S、SRC30A1S、SRC35A1S、SRC20A2S、SRC35B1S、SRC40B1S、SRC45B1S、SRC50B1S、SCC20A1S、SCC25A1S、SCC30A1S、SCC35A1S、SCC20A2S
(三)适用范围
产品与手术动力装置配合使用,用于骨科手术中打磨、切削组织和骨质。
(四)工作原理
产品通过内外刀管组件的联动,实现将手术动力装置(系统)微电机的动能通过接口、刀杆传递至前端磨头(刃部)处,实现对人体骨组织的打磨、切削。
二、临床前研究摘要
(一)产品性能研究
1.产品技术要求研究
技术要求研究项目如表1所示。

2. 产品性能评价
产品性能参数要求依据产品的实际性能,参考YY/T 1629.1-2018《电动骨组织手术设备刀具 第1部分:磨头》编制。性能评价主要包括外观、尺寸、粗糙度、硬度、连接强度、刃部强度、注水管、配合性能、无菌要求、环氧乙烷残留量等。结果表明产品符合设计输入要求。
(二)生物相容性
企业参考GB/T 16886.1-2011将产品同本公司生产的已上市产品一次性无菌微创脊柱变向磨钻头进行比对分析,通过结构组分、原材料成分及来源、化学表征、工艺及参数、灭菌方式和参数、助剂添加、接触方式(接触性质与时间)等方面进行比对,并进行毒理学风险评定,同已上市产品一次性无菌微创脊柱变向磨钻头相比,其生物相容性未产生新的风险。
(三)灭菌
该产品采用环氧乙烷灭菌,无菌状态提供。申请人提供了灭菌确认报告,证明无菌保证水平为10^-6。
(四)产品有效期和包装
申请人提供了产品老化试验报告,对老化前后的产品性能和初包装性能进行研究,支持产品有效期为3年。提交了产品外包装研究资料,证明包装完整性。
三、临床评价摘要
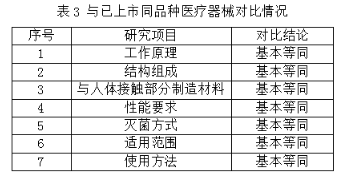
产品为列入《免于进行临床试验的医疗器械目录》产品。同豁免目录内容进行对比,结构组成、预期用途和标准要求基本等同;与已上市同品种医疗器械的比对情况如表3所示,在工作原理、材料、结构组成、性能要求、适用范围、使用方法等方面进行比对,基本等同。
四、风险分析及说明书提示
参照YY/T0316-2016《医疗器械风险管理对医疗器械的应用》,对该产品进行风险分析。对目前已知及可预测风险采取了风险控制措施,经综合评价,在目前认知水平下,认为该产品带来的获益/受益大于风险。为保证用械安全,需在说明书中提示以下信息:
(二)明确安装方法和使用说明。强调使用前检查、明确推荐转速范围;提示应注水冷却;明确配套使用的动力设备。
5、使用前检查冷却管路是否连接设置到位,过程中始终使用冷却冲洗,冲洗不当可能导致组织热坏死。
6、启动手柄,轻压患处,以轻扫方式去除骨(软)组织,请勿使用磨头撬动或推动骨组织,否则可能造成磨头断裂或锁死风险。
9、产品应根据所在地法律法规的要求按废品进行分类处理。
综合评价意见
申请人的注册资料符合现行要求,依据《医疗器械监督管理条例》(国务院令 第 680 号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令 2014 年第 4 号)等相关医疗器械法规与配套规章,经系统评价后,建议准予注册。
2020 年 8月 17日

